2019/9/05
高校無機の質問
byふくまるさん
A,たぶんこんなかんじだと思います。でもこれは正しい反応機構というわけではなく、説明のためのものです。反応機構自体は重要ではありません。だって単なる中和反応だもの。。。反応機構というものはもっと複雑な有機化合物を設計するために必要な地図のようなものです。ただ単なる中和反応の反応機構を論じるのは大げさすぎますし、無意味です。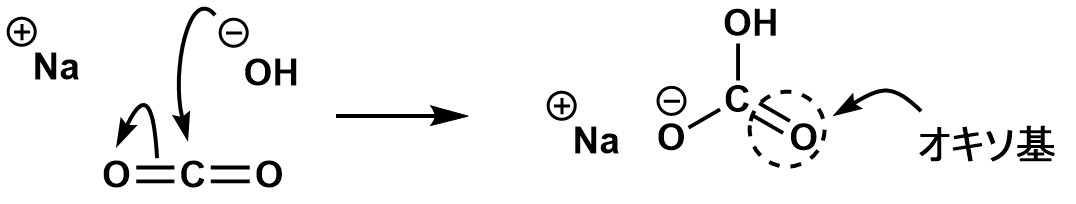
A,水素結合の強さと数のバランスです。
水素結合の強さはフッ化水素>水>アンモニア
水素結合の数は水=2、フッ化水素=アンモニア=1です。
注意なのは、アンモニアの場合、水が3個あるからといって水素結合が3個になるわけではないということです。アンモニアの窒素には非共有電子対が一つしかありませんので、一分子につき、水素を一つしか受容できません。そのため、水素結合の個数は1こになります。
2019/8/19
高校有機の質問
byふくまるさん
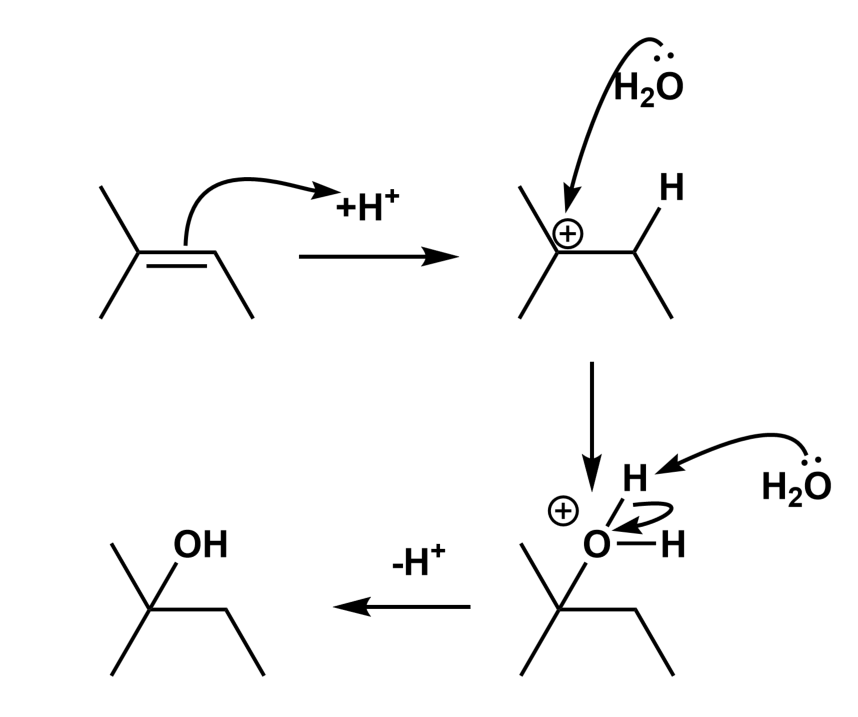
A,以下のようになります。置換基の多い方にヒドロキシ基が付加します。これをマルコフニコフ則といいます。
A、硝酸を脱水してニトロシルイオンを発生させるためです。 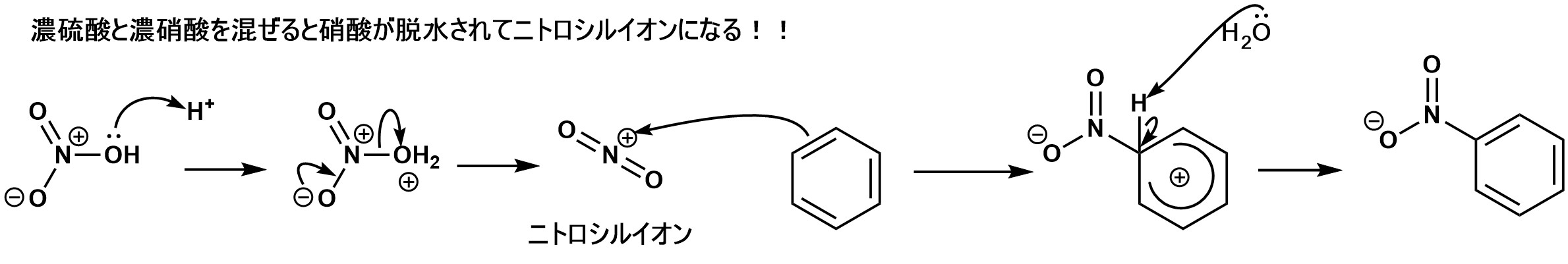
2019/8/18
空気-亜鉛電池 byほいちゃさん
空気ー亜鉛電池は正極活物質に空気中の酸素を利用するため、小型軽量で容量が大きい。放電時に負極では金属亜鉛が酸化され、水酸化物になると考えられえている。一方、正極では$\rm NaOH$あるいは$\rm KOH$を含む強塩基性電解液中での酸素の還元反応が利用される。正極材料の一部に用いられている酸化マンガンは触媒として働く。
(1)この電池の正極、負極で起こる反応を電子$\rm e^-$を含む反応式で示せ。
(2)負極の金属亜鉛6.5gが酸化されたとき、正極で消費される酸素の体積は標準状態で何Lか、ただし、Zn=65とし、有効数字二桁で答えよ。
(1)
正極の反応、
酸化とは電子を放出する反応です。なので、Znが電子を放出して亜鉛イオン$\rm Zn^{2+}$になる反応であると考えられます。
なので、
$$\rm Zn→Zn^{2+}+2e^-$$となります。
負極の反応は電子を受け取る反応です。酸素$\rm O_2$を使用しているとかいてあるので、$\rm O_2$が電子を受け取るのでしょう。そうすると、$\rm OH^-$ができるとしか考えられません。
よって,正極では
\begin{eqnarray}
\rm O_2&→&\rm 2OH^- \\
\rm O_2+2H^+&→&\rm 2OH^-(水素原子の数をプロトンH^+で合わせる) \\
\rm O_2+2H^++4e^-&→&\rm 2OH^-(電荷を電子e^-で合わせる) \\
\rm O_2+2H_2O+4e^-&→&\rm 2OH^-+2OH^-(塩基性条件なのでH^+とOH^-を中和させて水へ:つまり両辺に2OH^-を足す) \\
\rm O_2+2H_2O+4e^-&→&\rm 4OH^-\\
\end{eqnarray}という半反応式がかけます
(2)
(1)よりZn 1分子に対して$\rm O_2$が$\f12$分子反応することがわかります。
よって、亜鉛は0.1molなので反応した$\rm O_2$は0.05molこれに標準状態における1molあたりの理想気体の体積22.4Lをかけて、答えは
$$\rm 22.4[L/mol]×0.05[mol]=1.12[L]$$となります