Diels-Alder反応はペリ環状反応と呼ばれる種類の反応の1つです。
※ペリ環状反応とは、円を描くように電子が動き、正、または負の電荷をもついかなる中間体も経由しない反応のことです。
Diels-Alder反応は加熱するだけで進行します。反応全体としては$π$結合が2つ消えて、$σ$結合が2つ生じる付加環化という反応です。
Diels-Alder反応は、共役ジエンとアルケンの間で起こります。このアルケンを求ジエン体と呼びます。
ジエンはs-シス配座を取らなければならない
Diels-Alder反応において、ジエンはs-シス配座を取らなくてはいけません。
しかし、通常、ジエンは二重結合同士の立体反発を避けるために二重結合はお互い最も離れた位置、つまりs-トランス配座の状態にあります。
(s-シスというのはsingle-$cis$、s-トランスというのはsingle-$trans$のことで、中央の単結合からみて二重結合がシスの位置にある場合はs-シス、トランスの位置にある場合はs-トランスと表記します。)
そのように、ジエンは通常s-トランスというDiels-Alder反応には不利な配座をとっていますが、この中心の単結合の回転障壁は室温で約30kJ/molと小さいため、速やかにs-シスへ異性化します。
通常は上のように、s-トランスからs-シスに異性化してから反応することが多いですが、中には常にs-シスしか取らないジエンもあります。以下の環状ジエンは常にs-シス配座を取るため、Diels-Alder反応における優れた基質といえます。一方、同じ環状ジエンでも常にs-トランス配座しか取らないものももちろんあります。以下のようなものです。これはDiels-Alder反応を起こしません。
Diels-Alder反応の反応機構の軌道による解釈
Dilels-Alder反応では新しい結合が同時に2つできます。そのため、被占p軌道2つと空のp軌道2つが適切な位置関係と対称性を満たして出会う必要があります。例えば、アルケンのHOMO(π)と酸無水物のLUMO($π^*$)を考えます。この組み合わせでは一方は結合性に、他方は反結合性になるため、反応は起きません。アルケンのLUMO($π^*$)と酸無水物のHOMO($π$)の組み合わせでも軌道の対称性の不一致が生じてしまうので、うまくいきません。
しかし、アルケンをジエンを変えると、酸無水物のLUMOとジエンのHOMOは対称性が一致します。そのため、結合を作ることができます。また、ジエンのLUMOと酸無水物のHOMOも対称性が一致するので、これからも結合をつくることができます。このような軌道の対称性の一致によりDiels-Alder反応はおこると考えることができます。
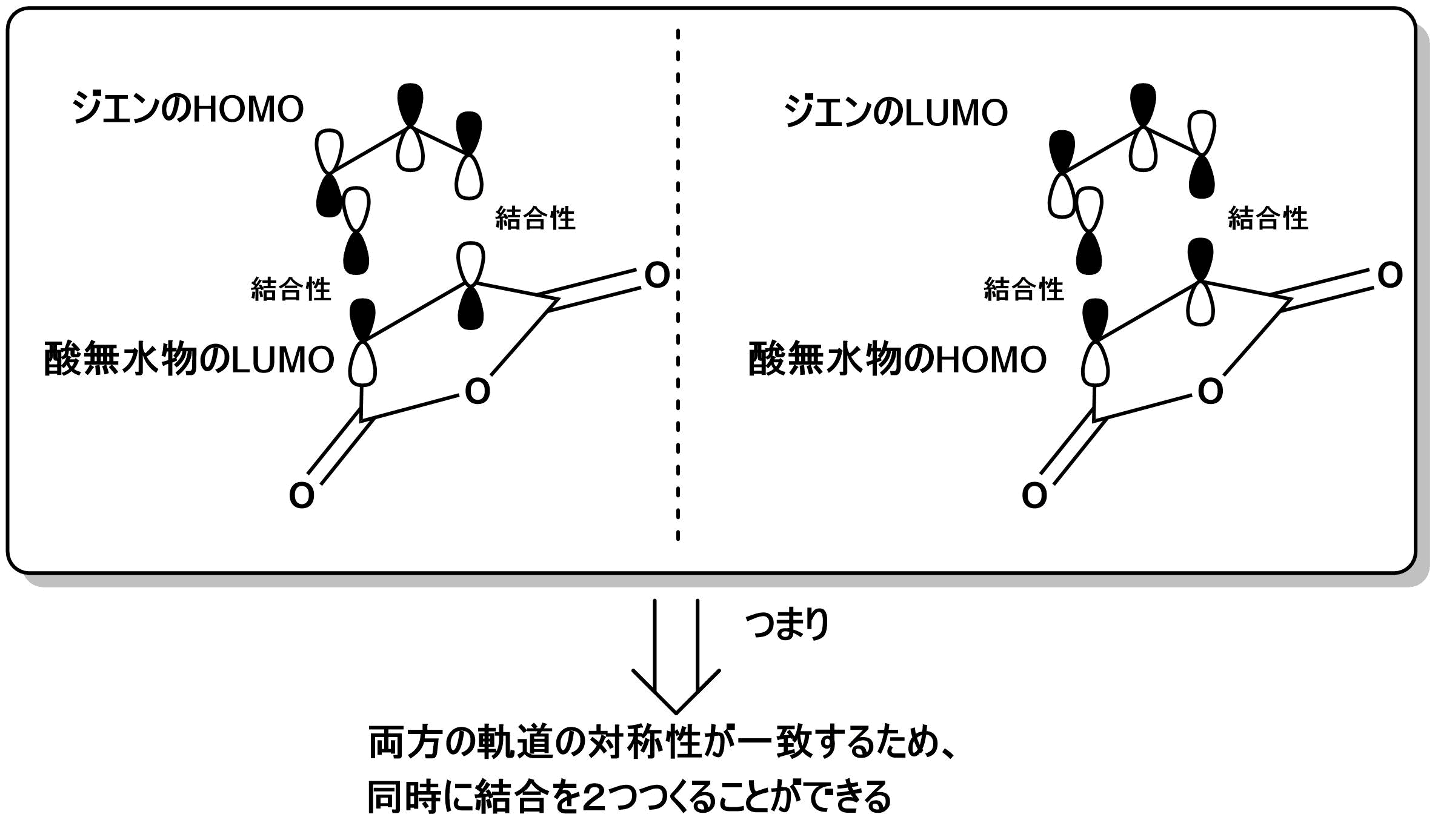
実際には、電子不足の求ジエン体と電子豊富なジエン間でのDiels-Alder反応が主なので、最初の組み合わせのほうが重要です。電磁不足の求ジエン体のLUMOのエネルギーは低く、電子豊富なジエンのHOMOのエネルギーは高いので、この組み合わせのエネルギー差は小さく、遷移状態における軌道の重なりが大きくなります。
共役基をもつ求ジエン体をDiels-Alder反応に用いる理由はここにあります。ジエンは比較的塩ルギー準位の高いHOMOを持つので、求電子剤に適していない。求ジエン体の反応生を最も効果的に高めるには、カルボニル基やニトロ基のような電子求引基を二重結合と共役させ、LUMOのエネルギー準位を下げれば良いことになります。電子豊富なジエンと電子不足な求ジエン体の組み合わせがDiels-Alder反応では一般的になります。
Diels-Alder反応におけるエンド則(立体選択性)
Diels-Alder反応でもっとも有名な反応はシクロペンタジエンと無水マレイン酸との反応です。
このDiels-Alder反応では生成すると考えられる化合物として2種類考えることができます。この2種類の立体異性を持つ化合物をエキソ体とエンド体といいます。
エキソ体とエンド体は以下のような定義です。
基本的にはエンド体とエキソ体では立体障害が小さいエキソ体のほうが安定です。
しかし、Diels-Alder反応では熱力学的には不安定なエンド体のほうが生成します。
つまり、速度論的にエンド体が有利な生成物である、もっと詳しくいうと、エンド体になるための遷移状態のエネルギーが何らかの原因により低下していると考えることができます。
その原因の説明としては、軌道による解釈などがありますが、実際にはよくわかっていないようです。