このページでは分光化学系列がなぜそのような順番になるのか、に対する定性的な説明を紹介したいと思います。
分光化学系列は配位子が錯体に与える配位子場の大きさの順序のことです。これは経験的に調べられているものなので、理論的に説明することは本来ナンセンスといえなくもありませんが、時々、問題として出題されることがあるので、こういうふうに説明されることがあるという程度に見ていただけると幸いです。
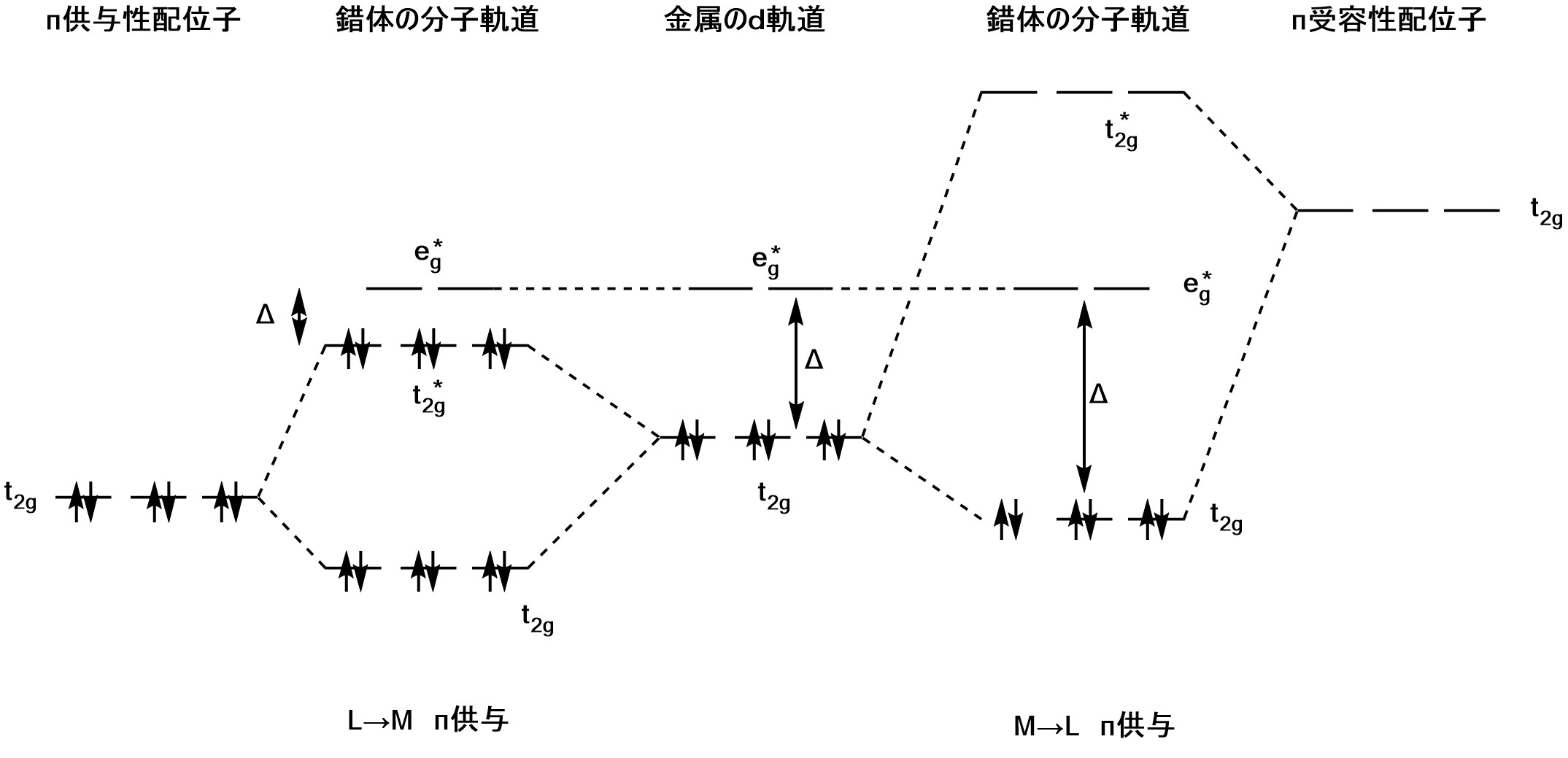
次に$π$結合が関与する場合を考えます。金属の軌道に対称性の会う配位子の$π$軌道は、$\rm t_{1u}(3個)とt_{2g}(3個)$です。$\rm t_{1u}$軌道は金属のp軌道と相互作用しますが、金属のp軌道がすでにσ結合に用いられている場合が多いため強く相互作用しません。したがって、配位子の$\rm t_{2g}π$軌道と金属の$\rm t_{2g}$軌道が最も強く相互作用することになります。
して、配位子の$\rm t_{2g}π$軌道のエネルギーがd軌道のエネルギーより低い場合と高い場合に分けて考えます。配位子が$π$対称性をもつ占有されたp軌道をもち、不飽和結合がなく、空の$π^*$軌道が金属のd軌道に接近したエネルギーにない場合、言い換えると非共有電子対をもつ$\rm Cl^-,I^-,OH^-$などの$π$供与生配位子(π-doner ligand)の場合以下のような形となります。この場合$π$供与性が強くなると$\rm t_{2g}$と$\rm t_{2g}^*$の分裂が大きくなり、$Δ$が小さくなるため、錯体は不安定化します。強い$π$供与性配位子($\rm I^-,Br^-,Cl^-,F^-,OH^-$)が分光化学系列で低い順にくるのはこのためです。しかし、$\rm Cr^{3+},Mn^{4+},V^{3+},V^{4+},Ti^{3+}$などのように$\rm t_{2g}d$軌道に入る電子が少ない場合には、部分的な$\rm L(配位子)→M(金属)$$π$供与により錯体は安定化されます。したがって、このようなイオンでは$π$供与性のないN配位子(アミンなど)よりもO配位子に対する親和力が高くなります。金属d軌道よりもエネルギーの低い$π$軌道が占有され、かつ、空の$π^*$軌道がd軌道に接近したエネルギーにある配位子($\rm CO,CN^-,NO^+,phen,bpy$など)の場合には、上図の左のようになります。このような配位子を$π$受容性配位子(π-acceptor ligand)と言います。
この場合は結合性の$\rm t_{2g}$軌道にd電子が入り、反結合性の$\rm t_{2g}^*$軌道は空であるため、配位子の$π$受容性が大きくなればなるほど分裂は大きくなり、その結果結晶場分裂パラメータ$Δ$も大きくなり、錯体は安定化します。$M→Lπ$逆供与は$\rm t_{2g}d$電子が多いほど大きくなり、金属ー配位子結合が安定化します。低原子価錯体にこのような結合が多く見られるのはこのためです。$\rm I^-$や$\rm P,As,S,Se$系配位子も$π$受容体となります。分光化学系列において$\rm CO$や$CN^-$などの強い$π$受容体が上位にあるのはこのような結果です。