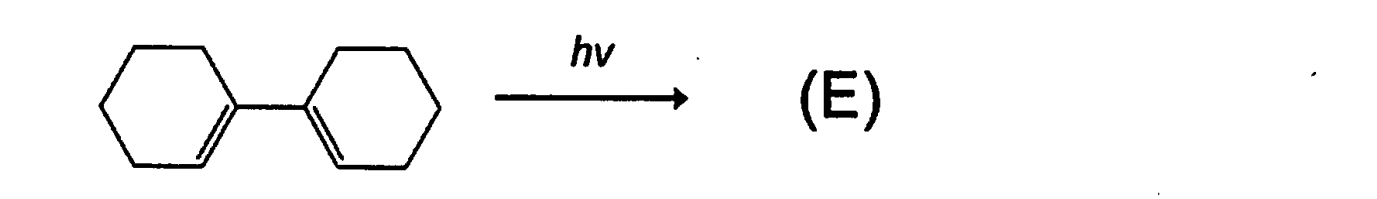
H29の問題はこちら
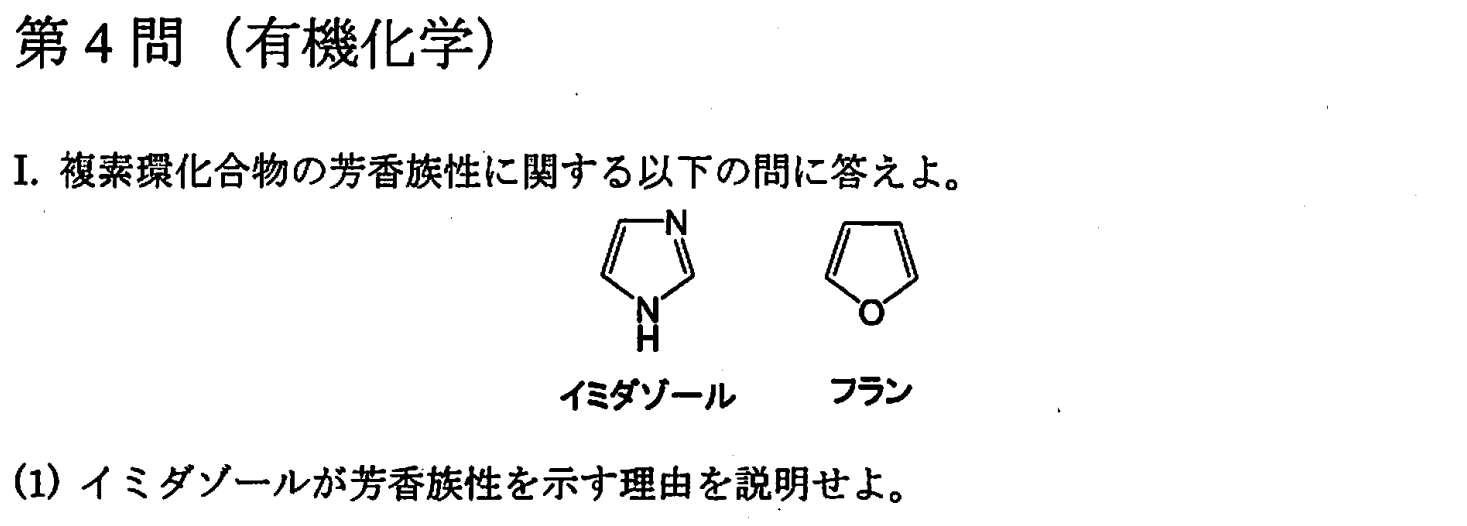 >NH窒素の非共有電子対がπ電子系に取り込まれ、6π電子系を形成するため。
>NH窒素の非共有電子対がπ電子系に取り込まれ、6π電子系を形成するため。
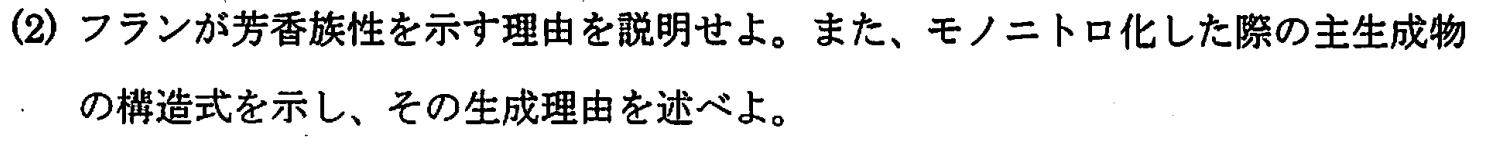 (1)と同じく、フランも酸素の2つの非共有電子対の内1つがπ電子系にとりこまれ、6π電子系を形成するため。
(1)と同じく、フランも酸素の2つの非共有電子対の内1つがπ電子系にとりこまれ、6π電子系を形成するため。
また、中間体が安定化されるため以下のような中間体ができる。
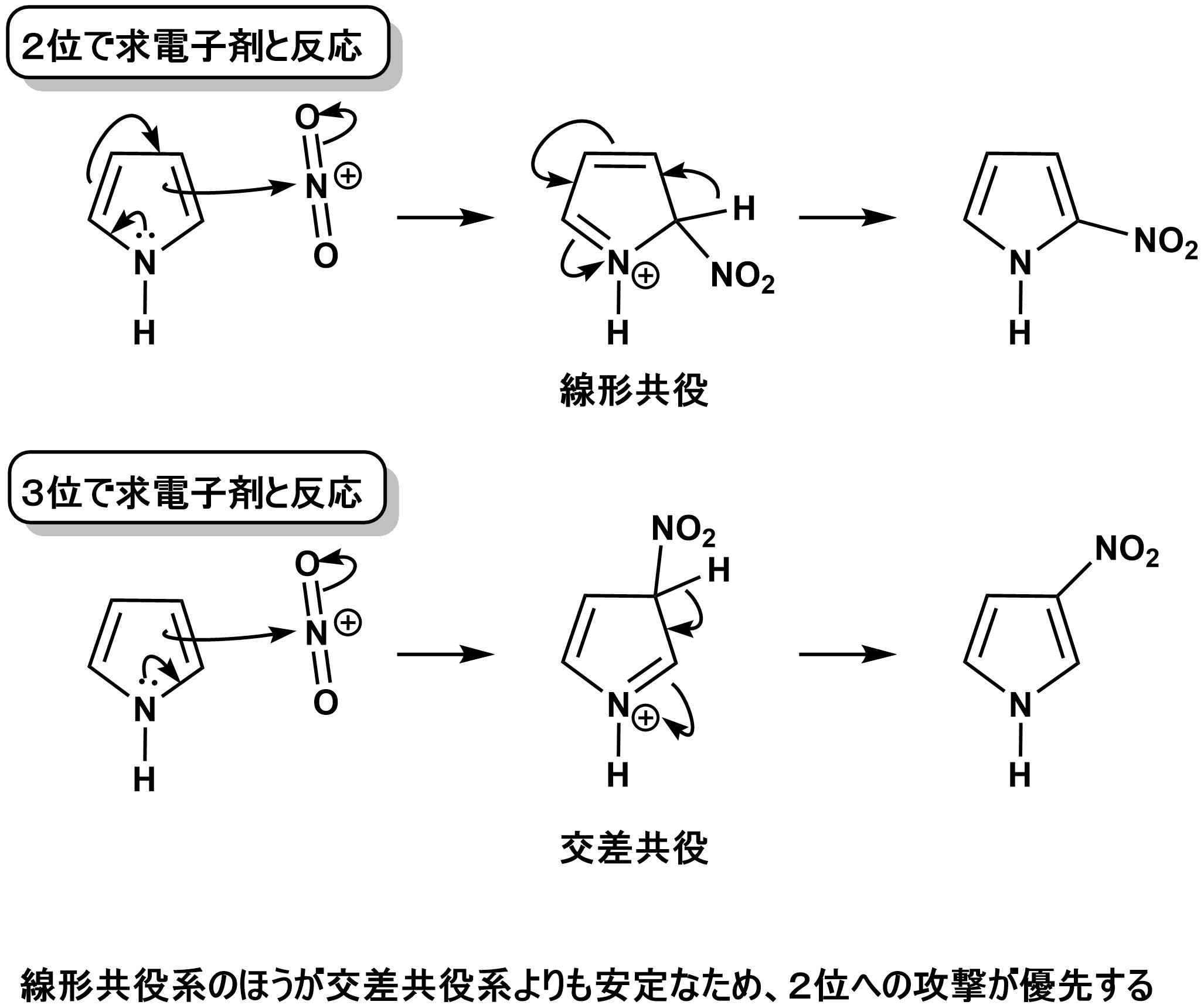 このとき、線形共役の方がより安定であるので、2位への攻撃が優先します。
このとき、線形共役の方がより安定であるので、2位への攻撃が優先します。
※補足
ただし、2位と3位の反応では確かに2位の方が有利のようですが、その差は小さく、置換はすべての箇所で起こる場合もあります。例えば、ピロールと臭素はLewis酸がなくても容易に求電子置換を起こし、4箇所すべてにおいて反応が起こり、臭素の4置換体になります。
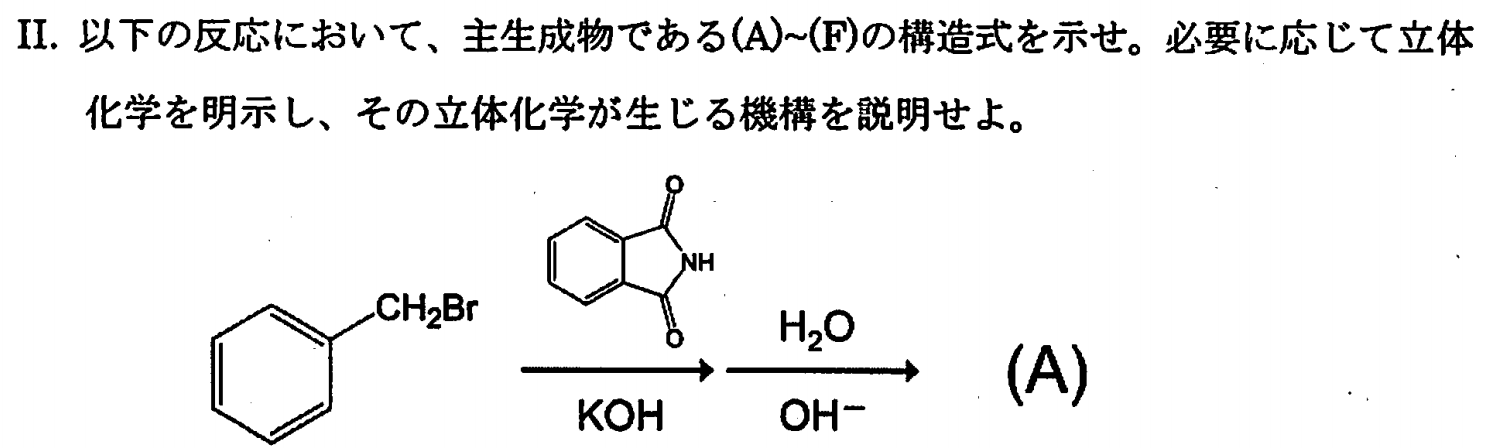
※Gabriel合成です。Gabrielアミン合成ではイミドのアルキル化が$S_N2$反応なので、適用できるのは第一級アルキル基をもつアミンだけになります。
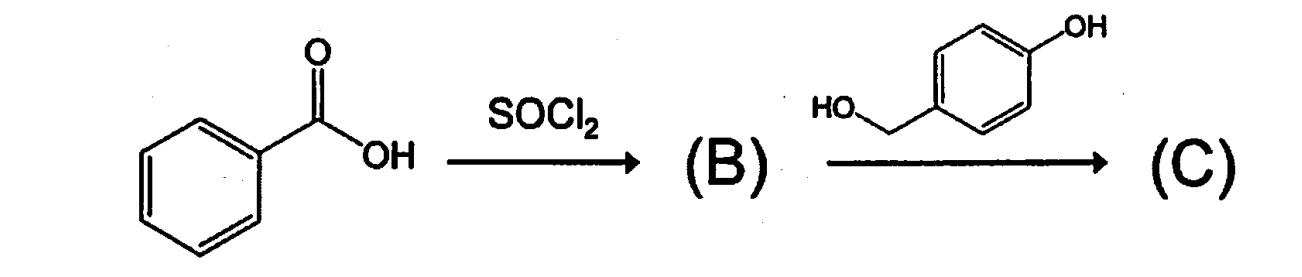
塩化チオニルで安息香酸を酸塩化物にした後の、アルコールとのエステル化反応である。フェノール酸素の非共有電子対がベンゼン環と共役安定化しているため、アルコール酸素より求核性が悪くなり、エステル化反応はアルコールが優先する。
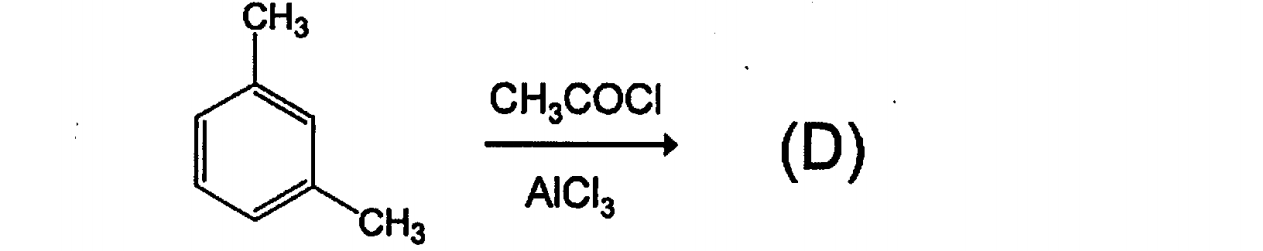 Friedel-Craftsアシル化である。アルキル基がオルトーパラ配向性なので、生成物は以下のようになる。
Friedel-Craftsアシル化である。アルキル基がオルトーパラ配向性なので、生成物は以下のようになる。
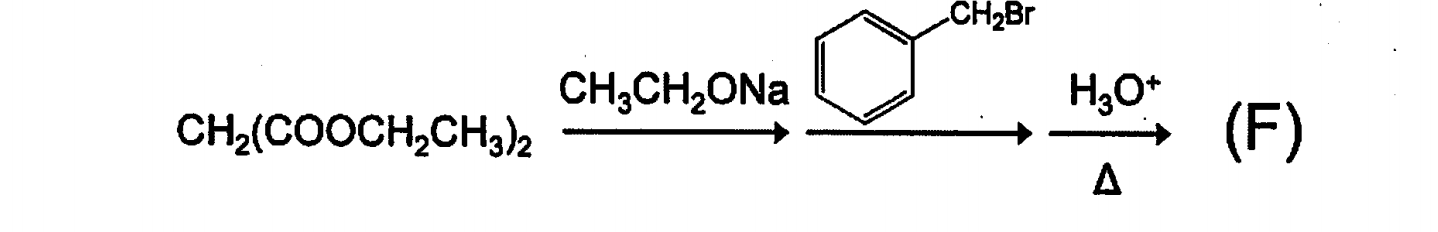 塩基によりα水素が引き抜かれた後、それが$S_N2$反応を起こし、加水分解の後に脱炭酸する。
塩基によりα水素が引き抜かれた後、それが$S_N2$反応を起こし、加水分解の後に脱炭酸する。
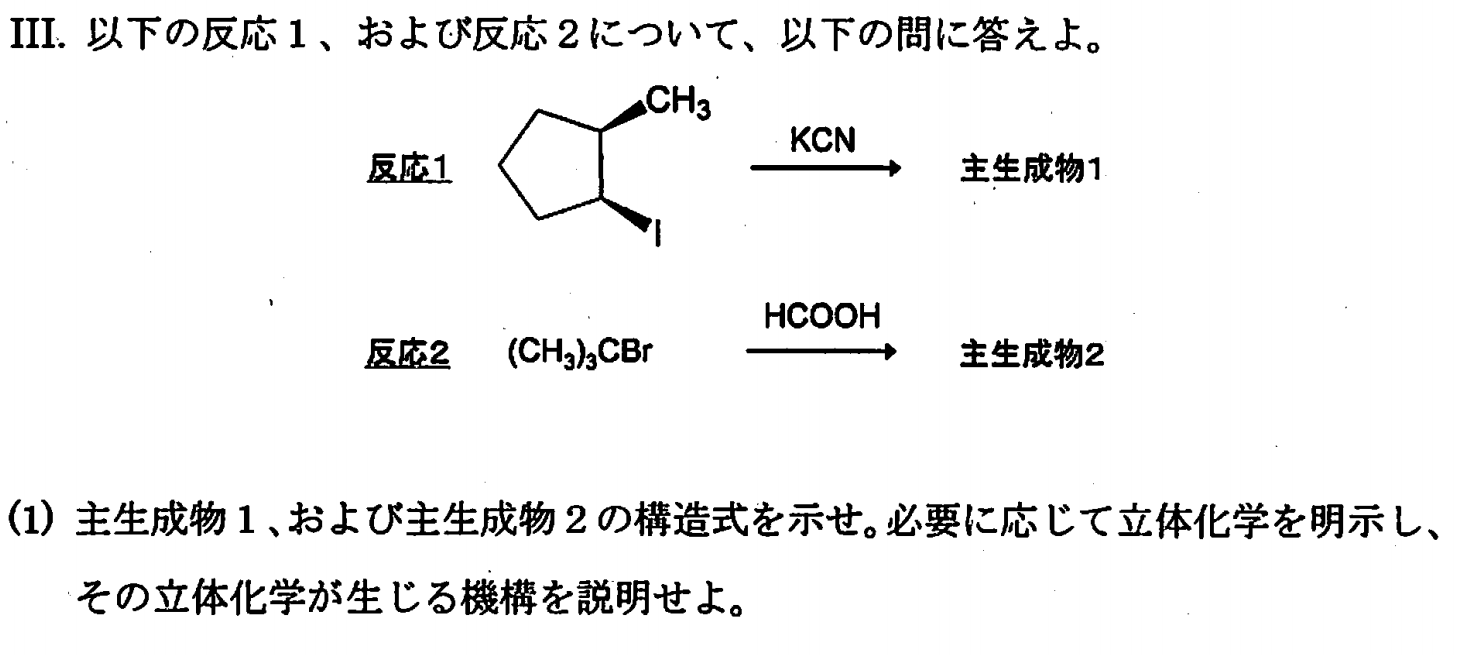 反応1は$S_N2$反応で、立体反転を伴うため、以下のような主生成物ができる。
反応1は$S_N2$反応で、立体反転を伴うため、以下のような主生成物ができる。
反応2は$S_N1$反応である。(※特に求核性の低いプロトン性溶媒(ギ酸)中における第二級アルキル体の反応は $S_N1$となります。)
反応2の参考PDFはこちら
 $S_N2$反応の反応速度は基質と求核剤の濃度の積の一次に比例するので、青酸カリウムの濃度増加の一次に比例して反応1の反応速度は増加する。
$S_N2$反応の反応速度は基質と求核剤の濃度の積の一次に比例するので、青酸カリウムの濃度増加の一次に比例して反応1の反応速度は増加する。
 プロトン性溶媒を用いると求核剤を溶媒和してしまい、反応性が減少するため反応速度は減少するが、非プロトン性極性溶媒は通常分子の内部に正電荷が存在し、表面には負電荷が露出しているため、求核剤は裸のアニオンとして存在し、求核性が上昇するため、反応速度は増加する。
プロトン性溶媒を用いると求核剤を溶媒和してしまい、反応性が減少するため反応速度は減少するが、非プロトン性極性溶媒は通常分子の内部に正電荷が存在し、表面には負電荷が露出しているため、求核剤は裸のアニオンとして存在し、求核性が上昇するため、反応速度は増加する。