特徴
まず、NBSから生じた臭素ラジカルがC-H結合にアタックして、カルボラジカルを生成するところから反応が開始する。そのため、解離エネルギーが小さいC-H結合が優先的にアタックされる。
そのため、級数が高い炭素のC-H結合が優先して切れる。特に、
アリル型のC-H結合は369kJ/molで典型的な第二級アルキル型C-H結合の410kJ/molより小さい。そのため、アリル型ラジカルは典型的なアルキルラジカルより40kJ/molほど安定であるためアリル型ラジカルが優先的に生じる。
また、ベンジル位もアリル位と同じように非常に切れやすいため、ベンジル型ラジカルも生じやすい。
反応機構
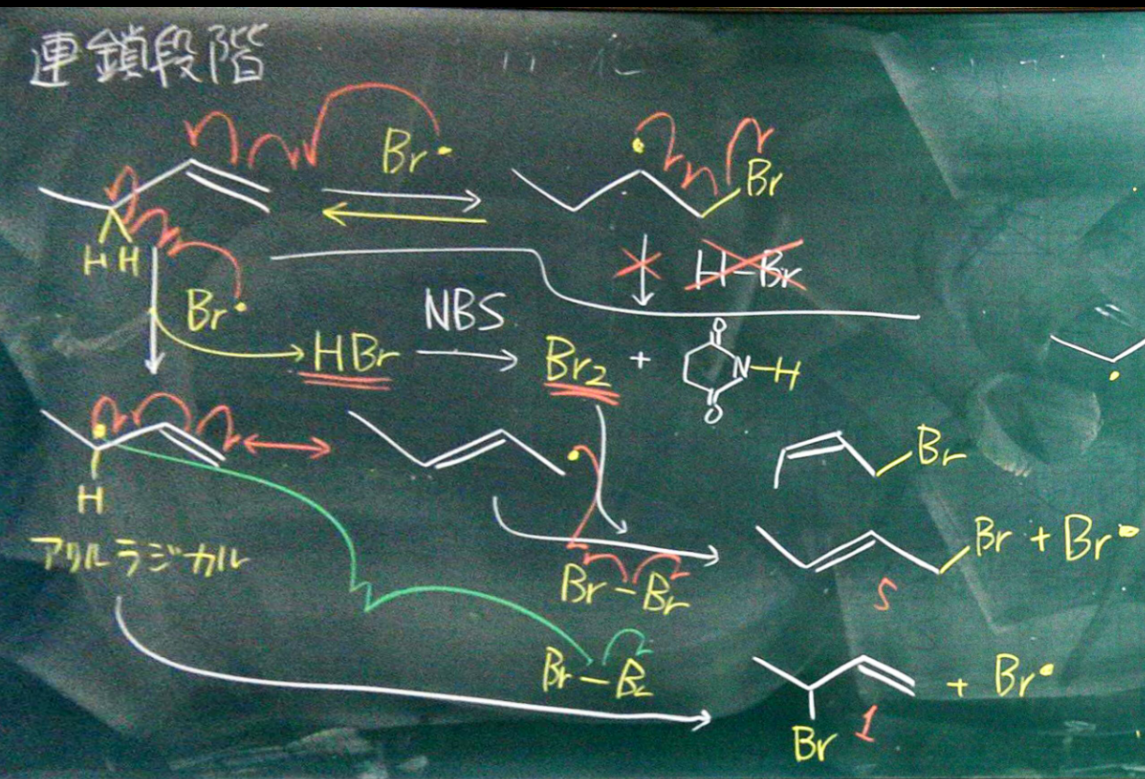
開始段階
NBSによるラジカルの射出
連鎖成長過程
まず、赤の矢印で示された反応(詳しくはこちら)が起こるが、この後反応できないのでまた元に戻る。
つまり、この反応は全体の反応に影響しない。
そのためアリル位がラジカルに変わる緑の反応が起こる。
その副生成物としてHBrが生成するが、それは余ったNBSのラジカルと反応してBr2が生じる。ここで生じたBrが緑の反応で生じたラジカルと反応するのだが、このラジカルはさらに共鳴を起こしているためここで複数の生成物が生じる。
Brはかさ高いため、すいている末端にBrが付く割合の方が高い。
割合にして1:5程度である。
さらに、上の反応においては、cisで固定するかtransで固定するかで2種類の生成物が生じる。その割合はcis:trans = 47:53となる。立体障害のためcisの方がわずかに割合が低い。
停止段階
ここでは省略する。
光学活性の消失
カルボラジカルはsp2混成のため、平面の構造をとる。
そのため、ラジカル臭素化による光学活性体への臭素付加により、光学活性が消失する場合がある。
そのような例として、以下の反応が挙げられる。
(s)-3-Metylhexaneをラジカル臭素化すると、光学不活性な3-Bromo-3-methylhexaneが主生成物として生じるが、これはカルボラジカルが平面構造をとることに起因するものである。
つまり、下の図における2回目の臭素ラジカルのアタックが両面当確率で起こるため、(S)と(R)が同量できてしまい、ラセミ体となって、光学活性が消失する。