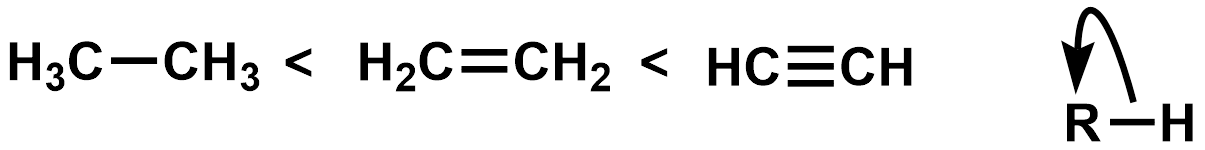
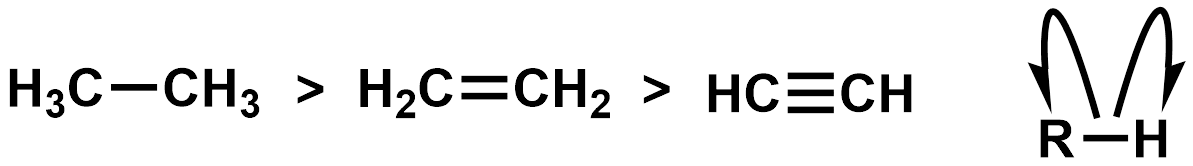エタンとエチレンとアセチレンの酸性度
いきなりですが、この3つの炭素酸の酸性度の順番は以下のようになります。
一方、C-H結合の強さは以下のようになります。
普通だったら、結合の強さが強いほどHは解離しにくいと考えられるため、酸性度は低くなると考えられますよね。
だからこそ、この2つのデータは一見矛盾しているように思えます。
このような違いはなぜ生じるのでしょうか?
まず、大切なのは、
酸性度とC-H結合の強さは相関があれども、同じものではない、ということです。
酸性度は上図に示した通り、結合電子対が完全にRに移る度合いを示したもので、
結合の強さは上図の通り、ラジカル的にそれぞれの原子に電子が移る度合いのことです。
このとき、酸性度に大きく影響する要因の一つに s性 というものがあります。
このs性が高いほど電子が原子核に近づきやすくなり、電子を受け取ったときに安定するのです。
このとき、3つの炭素酸の炭素のs性は、
アセチレン・・sp混成 → s性50%
エチレン・・・sp2混成 → s性33%
エタン・・・・sp3混成 → s性25%
となり、アセチレンの炭素のs性が最も高いものとなります。
そのため、アセチレンの炭素のs性が一番高いため、C-H結合が最も強いにもかかわらず、アセチレンの酸性度が一番高くなるのです。