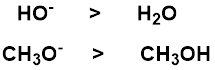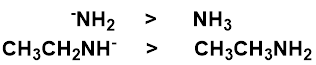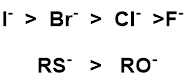求核性と塩基性の違い
求核性とは炭素への電子を与えやすさ($\rm C^{δ+}$に対する反応性)のことであり、塩基性とはプロトンのひきつけやすさ($\rm H^+$に対する親和性)のことです。
また求核性は速度論的な指標であり(不可逆な反応の指標であるということ)
塩基性は平衡論的な指標(可逆的な反応の指標であるということ)です。
このように、求核性と塩基性は別のパラメータではありますが、求核性が高ければ、塩基性も高い場合がほとんどです。
しかし、求核性が高くて、塩基性が低い場合や、求核性が低くても、塩基性が高い場合ももちろんあります。
求核性が高く、塩基性も高いケース
これはさきほど述べた通りで、
炭素に電子を与えることも、$\rm H^+$をひきつけるのも、基本的に電子豊富でないと起こらない現象です。
そのため、求核性が高い場合、その物質は塩基性も高い場合が多いです。
(求核性と塩基性は相関があるということ)
求核性が低く、塩基性が高いケース
これは、立体的なこみ具合が大きい試薬に当てはまります。
水素は通常、分子表面に存在し、容易に接近することができますが、炭素原子は水素や他の置換基の中心で、水素や他の置換基より奥まったところに存在しています。
そのため、立体的に込み具合が多きい試薬の場合、小さく、分子表面に存在するプロトンへの接近に比べ、炭素原子への接近が困難になる場合があります。この立体的要因により、求核性が低下しますが、塩基性はあまり変わりません。
求核性が高く、塩基性が低いケース
これは、ヨウ素などが例に挙げられます。
ヨウ素は分極率が高く、炭素と接触する可能性が高くなり、求核性は高くなります。一方、原子の大きさが大きいため、電子密度が小さくなる結果、水素を引き付ける力が弱くなり、塩基性は小さくなります。
他にも、シアニドイオン($\rm CN^-$)も良い求核剤ですが、弱い塩基(pKa=9)です。
求核剤の求核性
求核剤の求核性にはルールがあります。
求核攻撃する原子が同じものであれば、求核中心でマイナス電荷をもつほうが相手に電子を与えやすいので、求核性が強い。
酸素系求核剤では、
窒素系求核剤では、
となります。
求核中心の原子が同周期の場合、電気陰性度の小さいもののほうが負電荷の束縛が小さいので、外に向かって電荷を出しやすく求核性が高い。
求核中心の原子の周期が異なる場合、大きい原子の方が最外殻電子の束縛が少なく分極しやすいので相手に電子を与えやすい。すなわち、求核性は高い。
立体的に嵩高い求核剤は求核性が低い。
立体的に嵩高いと、立体障害のために炭素に近づくことが難しくなります。そのため嵩高いと求核性が低下します。
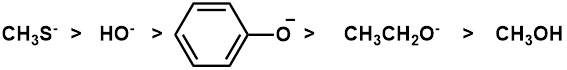
例題)以下の化学種を水溶液中における求核性の強いものから順に並べよ
(答え)
酸素原子よりイオウ原子の方が原子半径が大きく、分極しやすいので(電子を与えやすく)メタンチオレートの求核性が最も強い。チオレートでは電荷がより分散されているので水による溶媒和を受け難いということも求核性の強い要因である。他の酸素系求核剤のうち、電荷を持っていないメタノールが最も求核性が低い。残り3種では、アニオン種の安定性を比較する。水酸化物イオンは共鳴構造式が書けない(すなわち、電荷の分散がない)ので、一番エネルギー的に高い。すなわち、一番不安定で反応性に富んでいるので求核性も一番高い。
フェノラート(phenolate、フェノキシド)とアセタート(acetate)は上の様に共鳴構造式が書けるが、同形の混成体からなり、電気陰性度の高い酸素分子2つで電子を分散できる後者の方が安定性が高い。よって、求核性はフェノラート>アセタートとなる。
よって水溶液中での求核性の順番は以下のようになる。