
Friedel-Craftsアルキル化では、アルキル基が活性化基なので一回水素をアルキル基で置換した後の、続けて起こるアルキル化を避けることができず、生成物の選択性が良くない。さらに、第一級カルボカチオンは転移を起こして、より安定な第二級、第三級カルボカチオンになり、主生成物として第一級アルキル基を導入することができないため。
 アルキル化では酸触媒が反応内で再生するので、Lewis酸は微量でよい。しかし、アシル化では、塩化アルミニウム触媒のもとアシルカチオンが生成したときに、酸素原子の孤立電子対とアルミニウム原子が相互作用して錯体を形成し、酸素原子上にとどまるために触媒の活性が落ちてしまうため、酸触媒は多量に必要である。
アルキル化では酸触媒が反応内で再生するので、Lewis酸は微量でよい。しかし、アシル化では、塩化アルミニウム触媒のもとアシルカチオンが生成したときに、酸素原子の孤立電子対とアルミニウム原子が相互作用して錯体を形成し、酸素原子上にとどまるために触媒の活性が落ちてしまうため、酸触媒は多量に必要である。

a S
b R
c S
 E2脱離はanti-periplanerの立体配座で起こります。
E2脱離はanti-periplanerの立体配座で起こります。
※この反応はE1脱離ではありません。E1脱離であるならば、生成物はより熱力学的に安定な
となります。(Zaytsev型脱離)
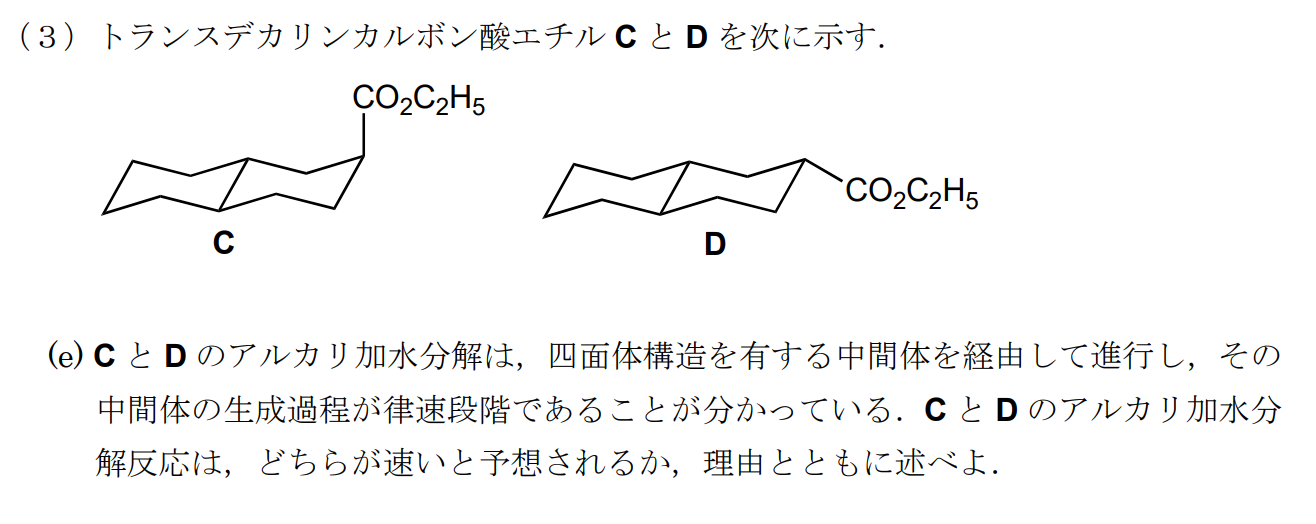 cのほうがジアキシアル相互作用による立体障害が大きく、四面体構造になることでその立体障害が更に大きくなると思われる。そのため、中間体が不安定なCは分解反応が遅くなると思われる。つまり、Dの分解反応のほうが速い。
cのほうがジアキシアル相互作用による立体障害が大きく、四面体構造になることでその立体障害が更に大きくなると思われる。そのため、中間体が不安定なCは分解反応が遅くなると思われる。つまり、Dの分解反応のほうが速い。
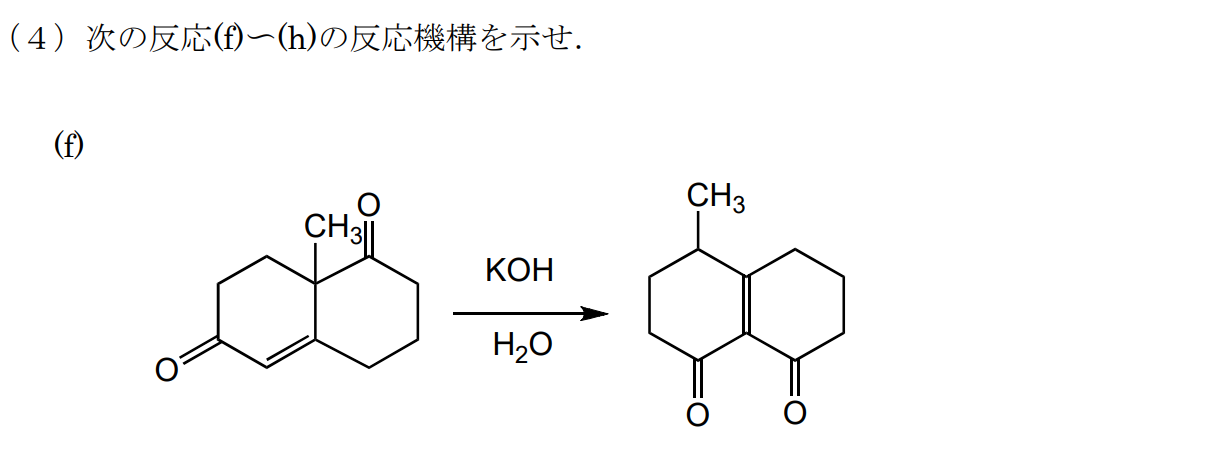
$\rm OH^-$によるマイケル付加の後、分子内アルドール縮合反応が起こると考えられます。
これはCannizzaro反応という、アルデヒドの不均化反応です。アルデヒドは一般に水中で少なくとも一部の分子は水和されています。この水和反応は塩基触媒が促進し、以下の図のように、水和物アニオンを生じます。ただし、α水素がなく、アルデヒドがエノール化できない場合、塩基が十分強いか、高濃度であるときにには、一部の水和物アニオンが更に脱プロトンされ、水和物ジアニオンになります。
このジアニオンは非常に不安定なので、アシル置換反応での脱離のように、ヒドリド$\rm H^-$が脱離していきます(脱離候補である$\rm O^{2-},R^-,H^-$の中では$\rm H^-$が一番脱離能がある)。しかし、そのまま放出されるのではなく、アルデヒドの水素化ホウ素還元のように、アルデヒドにアタックしていき、アタックされたアルデヒドはアルコールになります。これは、水素化ホウ素などのヒドリド供与剤によるアルデヒドからアルコールへの還元と同じ機構です。
参考)ウォーレン有機化学 上 第二版 p644
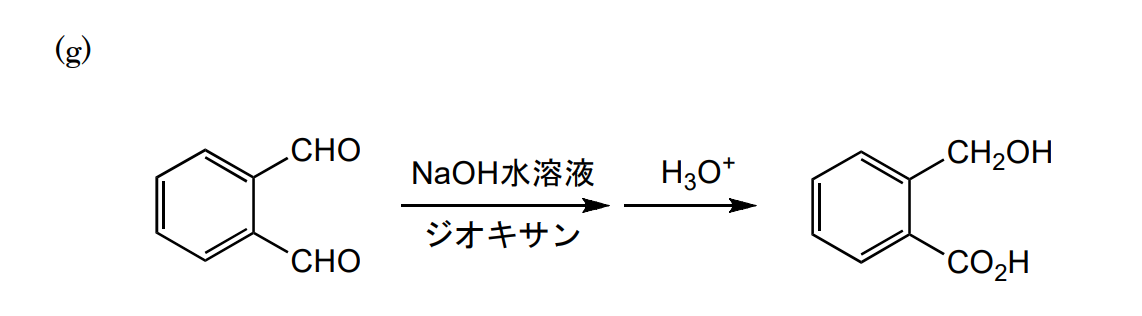
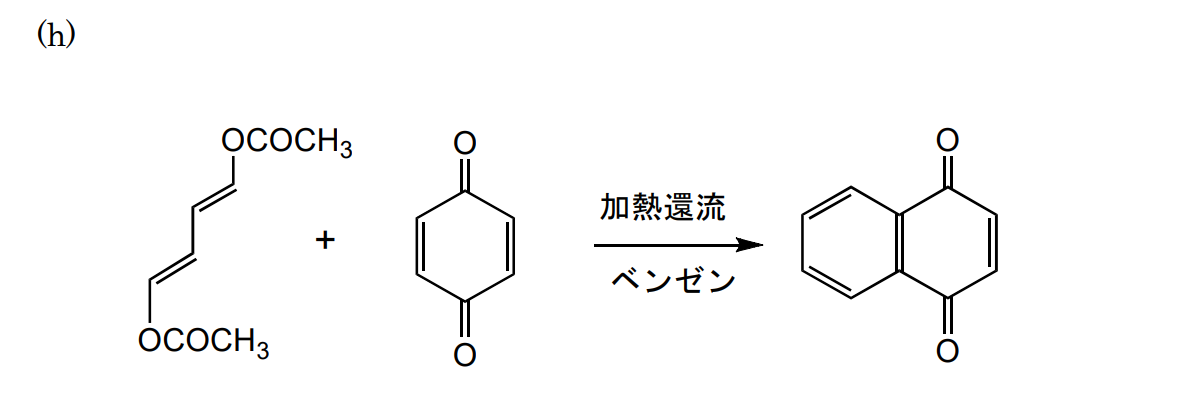 どのような反応機構かわかりませんでした。なので、以下のような経路を書いてみました。正しいかどうかはわかりません。
どのような反応機構かわかりませんでした。なので、以下のような経路を書いてみました。正しいかどうかはわかりません。