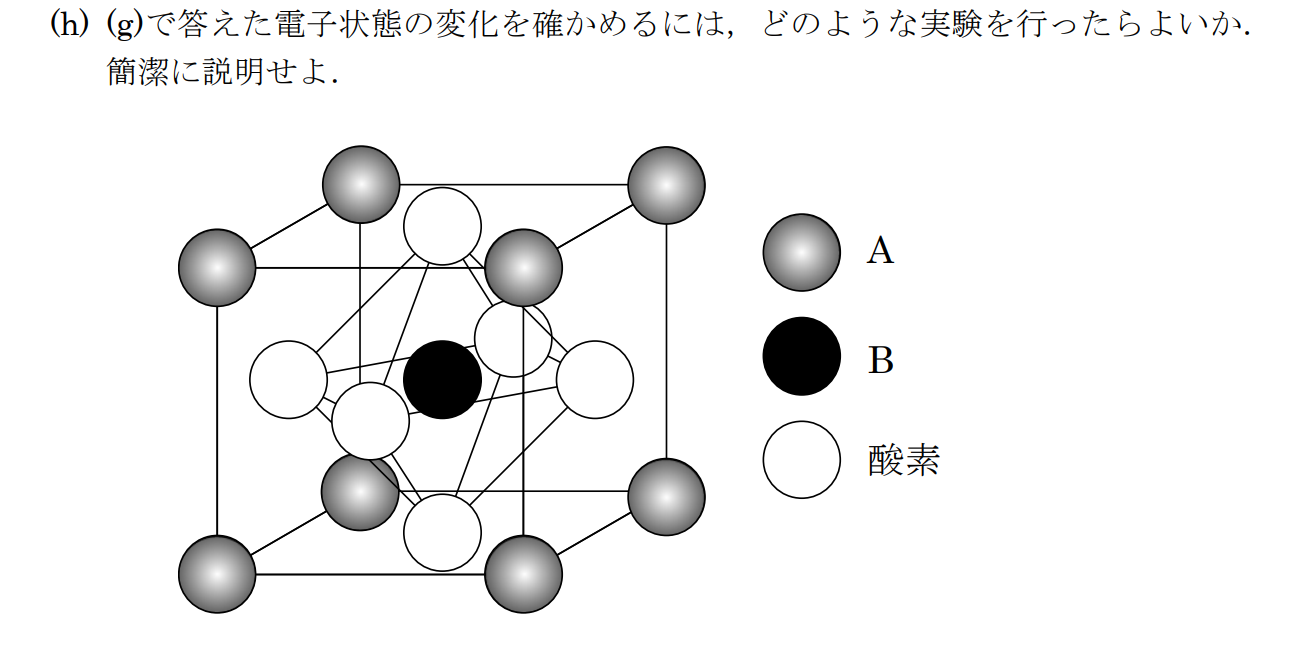

ペロブスカイト型構造は$\rm BO_6$八面体が互いに頂点を共有して結晶の3つの軸方向に連なった構造であり、Aイオンは12個のXイオンに囲まれた空隙を埋める。
※一応のペロブスカイト型の記述です
ペロブスカイト構造は、12個のXアニオンで囲まれたAカチオンと6個のXアニオンで囲まれたBカチオンとをもつ立方体形の構造である。実際、ペロブスカイト型構造はAイオンと酸化物イオンと酸化物イオンの記述でき、Bカチオンは6個の酸化物イオンからできる八面体間隙をすべて占有する。この結果$\rm B_{n/4}[AO_3]_{n/4}$となり、これは、$\rm ABO_3$と等価である。酸化物では$\rm X=O$であるから、AとBとの電荷数の和は$+6$でなくてはならないが、その内訳はいろいろで$\rm A^{2+}B^{4+}やA^{3+}B^{3+}$である。$\rm A(B_{0.5}B’_{0.5})O_3$で表される混合酸化物の可能性もある。
参考)シュライバー・アトキンス 無機化学 上 第6版 p

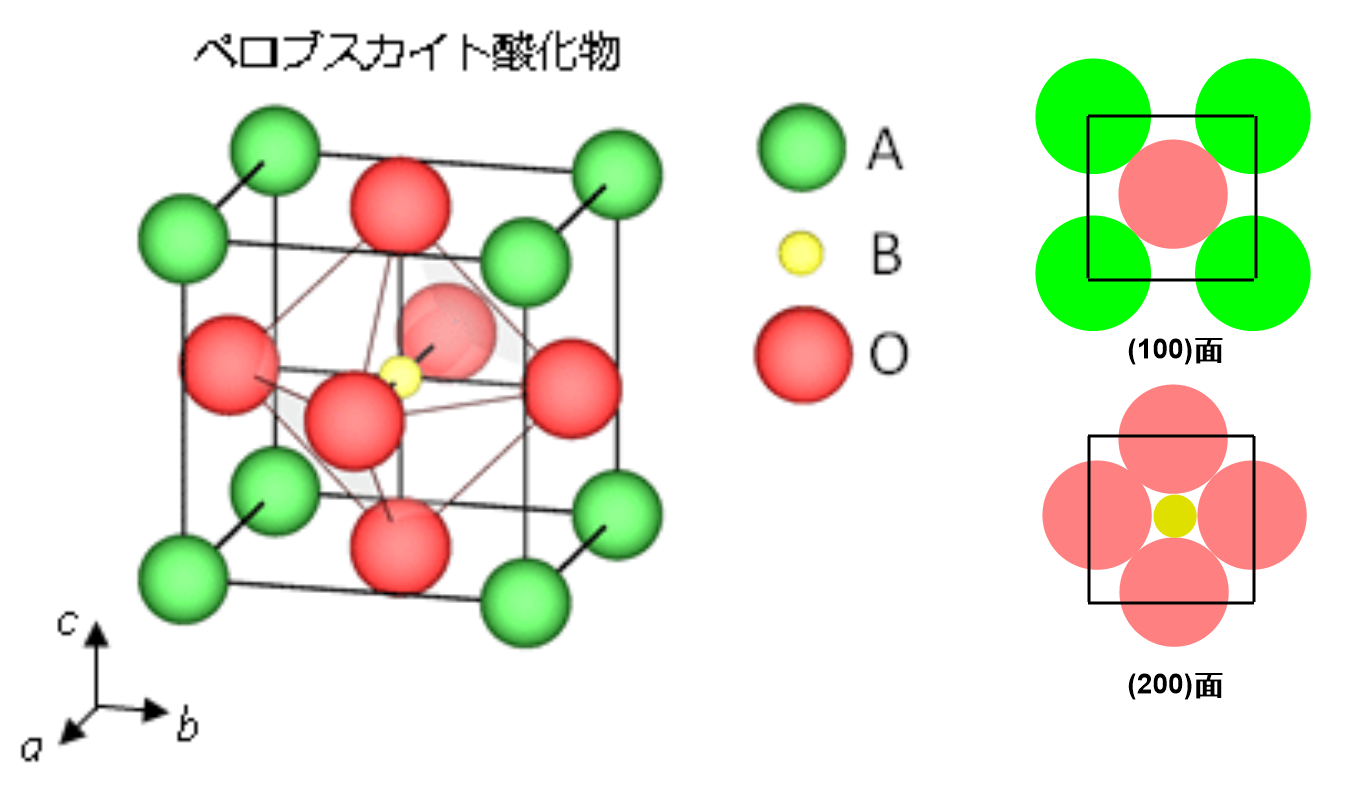 イオン結晶では陽イオンと陰イオンは接触するので、理想的なペロブスカイト型構造では、以下の図に示すように(100)面、(200)面において、次の関係にある。
イオン結晶では陽イオンと陰イオンは接触するので、理想的なペロブスカイト型構造では、以下の図に示すように(100)面、(200)面において、次の関係にある。
\begin{eqnarray}
2(r_A+r_O)&=& \sqrt 2{a}\tag{(100)面}\\
⇔r_A+r_O&=&\f{a}{\sqrt 2}\\
2(r_B+r_O)&=&{a} \tag{(200)面}\\
⇔r_B+r_O&=&\f{a}{2}\\
よって&、&この二式より\\
r_A+r_O&=&\sqrt 2(r_B+r_O) \\
\end{eqnarray}の関係が得られる。