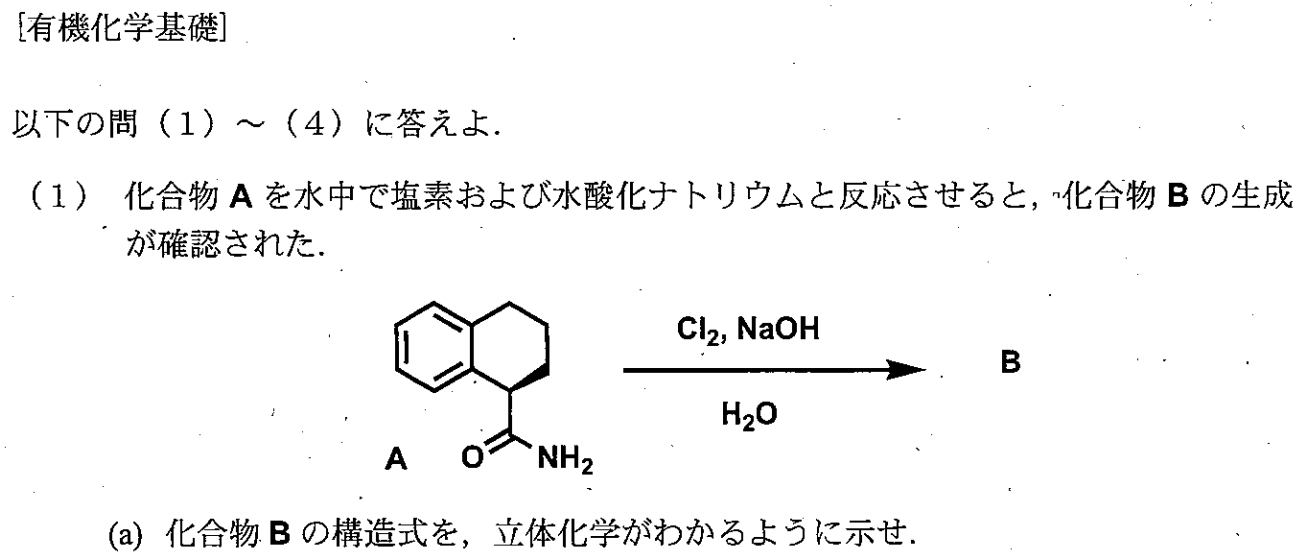
この反応はHofmann転移です。過程は以下の通りになります。
また、転移反応では一般的に1,2移動において、移動する基の立体配置は保持されます。その理由は、転移反応で移動する炭素原子$\rm S_N2$反応のように求核攻撃を受けるのではなく、求電子攻撃を受けるからです。$\rm S_N2$反応では、置換を受ける炭素において使用される軌道は、結合性σ軌道ではなく、反結合性σ*軌道なので、反転が起こります。一方、転移においては、移動する炭素の$sp^3$軌道は、分子全体の構造をなるべく変えないように、ある軌道から別の軌道に滑り込みます。この際、$sp^3$軌道の大きい方のローブが、移動する基があったのと同じ側で新しい結合を形成するのに使われ、立体配置は保持されることになります。つまり、転移の際、転移する炭素において使用される軌道は、反結合性σ*軌道(LUMO)ではなく、結合性σ軌道(HOMO)なので、立体配置が保持されます。
これは、(c)の問題の答えです。
参考)ウォーレン有機化学 下 第二版 p1017(転移の立体化学保持) p1092(Hofmann転移)
アシルナイトレンが生じる過程は以下の通りです。
参考)ウォーレン有機化学 下 第二版 p1092
$\rm S_N2$反応では、置換を受ける炭素の反結合性σ*軌道が使用されるため反転が起こるが、転移における1,2移動では、移動する炭素において使用される軌道は結合性σ軌道である。そのため、立体配置が保持される。
参考)ウォーレン有機化学 下 第二版 p1017

これはBaeyer-Villiger酸化という転移反応です。反応機構は以下のようになります。
Baeyer-Villider酸化も「転移の1,2移動において、移動する基の立体配置は保持される」という転移の原則が当てはまります。また、Baeyer-Villiger酸化において、転移するアルキルは、電子供与性が高いほど転移しやすいです。
参考)ウォーレン有機化学 下 第二版 p1017
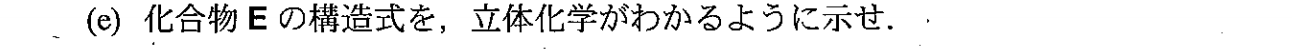
エステルの加水分解反応だと思われます。
ただし、立体化学は正しい書き方についてはわかりませんでした。
 上図の最終生成物です。
上図の最終生成物です。
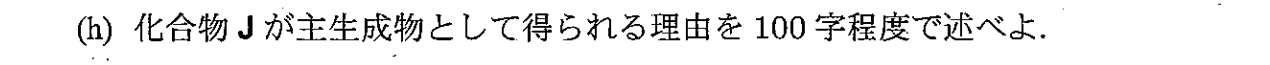 電子求引性であるベンゼン環による共鳴安定化のため、アニオンGのほうが安定化する。そのため、G’よりもGのほうができやすくなり、よって、Jが主生成物となる。
電子求引性であるベンゼン環による共鳴安定化のため、アニオンGのほうが安定化する。そのため、G’よりもGのほうができやすくなり、よって、Jが主生成物となる。
