 (a)ランタノイド収縮とは、f軌道に電子が収容されていく過程であるランタノイドにおいては、周期表を左から右に行くに従って原子半径が小さくなるというものである。これは、f軌道の遮蔽効果が小さく、f軌道に電子が収容されるほど、最外殻電子の有効核電荷が大きくなるからである。
(a)ランタノイド収縮とは、f軌道に電子が収容されていく過程であるランタノイドにおいては、周期表を左から右に行くに従って原子半径が小さくなるというものである。これは、f軌道の遮蔽効果が小さく、f軌道に電子が収容されるほど、最外殻電子の有効核電荷が大きくなるからである。
 (b)クロマトグラフィーにおいて、そのクロマトグラフィーの性能を示す目安である。クロマトグラフィーは分配を連続的におこなっているが、これを仮想的に、何個もの分液漏斗をつなげたものだと考えたときに、その分液漏斗の個数に相当するのが、理論段数である。この理論段数はクロマトグラフィーの長さと、分配係数に比例して大きくなる。
(b)クロマトグラフィーにおいて、そのクロマトグラフィーの性能を示す目安である。クロマトグラフィーは分配を連続的におこなっているが、これを仮想的に、何個もの分液漏斗をつなげたものだと考えたときに、その分液漏斗の個数に相当するのが、理論段数である。この理論段数はクロマトグラフィーの長さと、分配係数に比例して大きくなる。

共通イオン効果とは、水溶液中のイオンを沈殿として取り出したいときに、沈殿を構成するイオンのうち、一方のイオンを含むイオン性物質を添加することで、目的物質が沈殿しやすくなるというものである。これは、$A^++B^-⇄AB(沈殿)$という平衡状態において、イオンを添加することで、その変化を緩和する向きに平衡が偏った結果沈殿の量が増えるというルシャトリエの原理の実践である。しかし、あまりにイオンを添加しすぎると、今度は共存イオン効果の方が優勢になるため、添加するイオンは多すぎてはいけない。

C-C結合間距離とB-N結合間距離は等電荷になるため、非常に似ている。そのため、構造的には窒化ホウ素化合物は炭素化合物とよく似た構造を取ることができる。ベンゼンと等電荷体である窒化ホウ素化物はボラジンと呼ばれ、無機ベンゼンと呼ばれることもある。しかし、構造的には似ていても、性質は全く異なる。その理由は、BとNの電気陰性度が異なり、電子が局在化するためである。つまり、無機ベンゼンは芳香族性を持たない。その証拠として、ベンゼンとはことなり、無機ベンゼンには基底状態において、絶縁性であり、また置換反応ではなく、付加反応を起こしやすい。
 ハプト数は錯体において、中心の金属と1つの配位子間における結合の数のことである。例えば、フェロセンの場合、配位子はシクロペンタアニオンであるが、このシクロペンタアニオンの全炭素5つで鉄に配位している。そのため、ハプト数は5になる。
ハプト数は錯体において、中心の金属と1つの配位子間における結合の数のことである。例えば、フェロセンの場合、配位子はシクロペンタアニオンであるが、このシクロペンタアニオンの全炭素5つで鉄に配位している。そのため、ハプト数は5になる。
 二酸化ケイ素はダイヤモンド型構造をとり、Siは4つの酸素と配位している。
二酸化ケイ素はダイヤモンド型構造をとり、Siは4つの酸素と配位している。
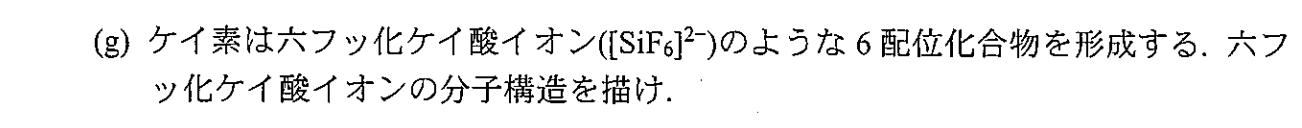 6配位八面体型錯体であると思われます。
6配位八面体型錯体であると思われます。
炭素の場合、原子の大きさが第三周期以降の元素と比べて小さいため、原子価殻に4つ以上の電子対を配置するのは難しいが、ケイ素は炭素と比べ大きく、かつ空のd軌道を持っているため、それを利用して、原子価殻の電子が8個以上になることができるため。
$\rm Si$は$\rm C$と比べて電気陰性度が低いため、$\rm N-Si$結合は$\rm N-C$結合よりも極性が大きくなる。そのためトリシリルアミンではシリル基間の反発的な長距離力が働き、平面構造を取る。トリメチルアミンはそのような反発力はないため、三角錐型構造を取る。

