(b)と(d)
(b)と(d)
 $\newcommand\bf{{[\rm BF_3]}}\newcommand\bcl{{[\rm BCl_3]}}\newcommand\et{{[\rm Et_2O]}}\newcommand\etbf{{[\rm Et_2O・BF_3]}}\newcommand\etbcl{{[\rm Et_2O・BCl_3]}}$
$\newcommand\bf{{[\rm BF_3]}}\newcommand\bcl{{[\rm BCl_3]}}\newcommand\et{{[\rm Et_2O]}}\newcommand\etbf{{[\rm Et_2O・BF_3]}}\newcommand\etbcl{{[\rm Et_2O・BCl_3]}}$
\begin{eqnarray}
K_1&=&\f{\etbf}{\et\bf}\tag{1} \\
K_2&=&\f{\etbcl}{\et\bcl}=4.7×10^2 \\
\f{0.62}{\et×0.38}&=&4.7×10^2 \\
\et&=&\f{0.62}{4.7×10^2×0.38} \\
これを(1)に代入すると&、& \\
K_1&=&\f{\etbf}{\et\bf}\\
&=&\f{0.38}{\f{0.62}{4.7×10^2×0.38}×0.62}\\
&=&\f{0.38^2×4.7×10^2}{0.62^2}\\
&=&1.765×10^2\\
&=&1.77×10^2
\end{eqnarray}

$\rm BCl_3$と$\rm BF_3$はいずれも結合次数が1.33でp軌道を用いたπ結合、つまり、二重結合性が存在するが、ルイス酸として機能する場合、$\rm sp^2$軌道から$\rm sp^3$軌道にならなくてはならないため、この二重結合性を切断する必要がある。この二重結合性は軌道エネルギーがBと近いほど強いため、$\rm BF_3$のほうがルイス塩基の孤立電子対を受け入れるルイス酸性は低くなるため、$K_2>K_1$となる。
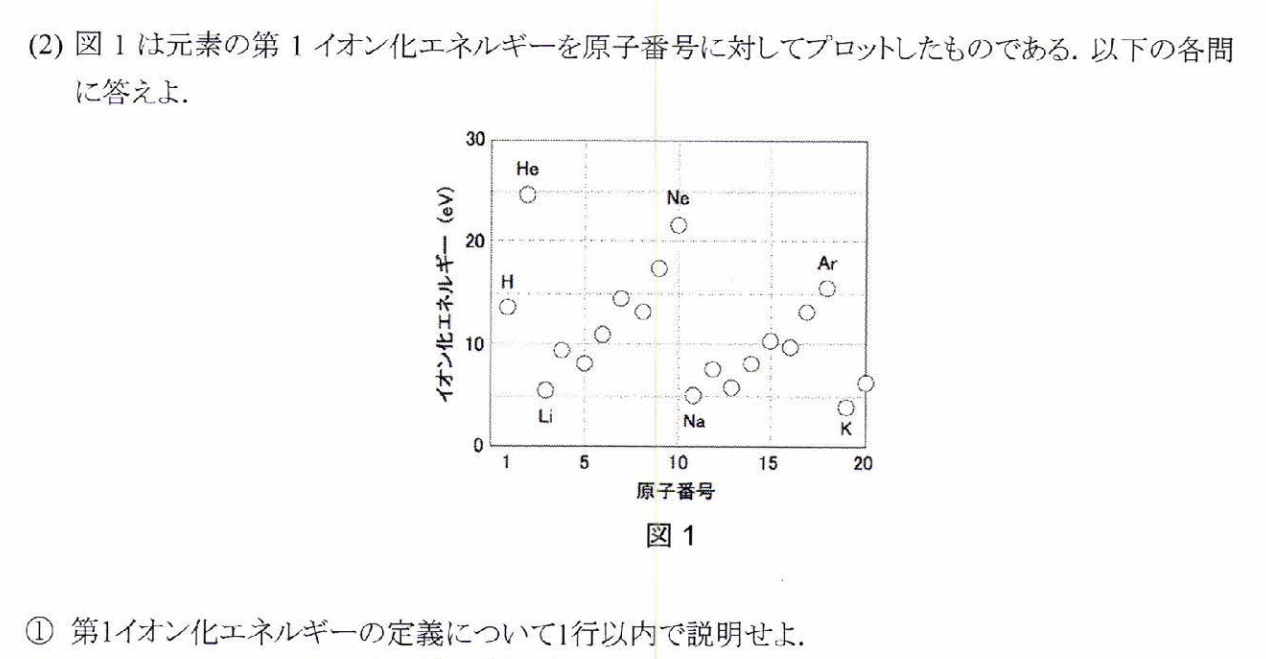 その元素の気体原子から電子一個を奪い、一価の陽イオンにするために必要なエネルギー。
その元素の気体原子から電子一個を奪い、一価の陽イオンにするために必要なエネルギー。
 (a)近く (b)遮へい (c)増加 (d)増加
(a)近く (b)遮へい (c)増加 (d)増加
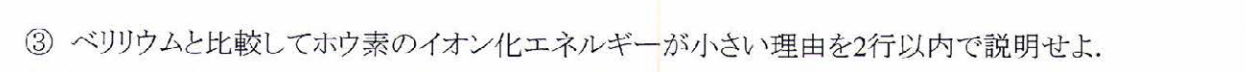 ベリリウムは最外殻電子が閉殻となっているため、安定であり、一方のホウ素の最外殻電子は2p軌道という2s軌道より原子核から遠く、エネルギー準位が高い軌道にあるため。
ベリリウムは最外殻電子が閉殻となっているため、安定であり、一方のホウ素の最外殻電子は2p軌道という2s軌道より原子核から遠く、エネルギー準位が高い軌道にあるため。
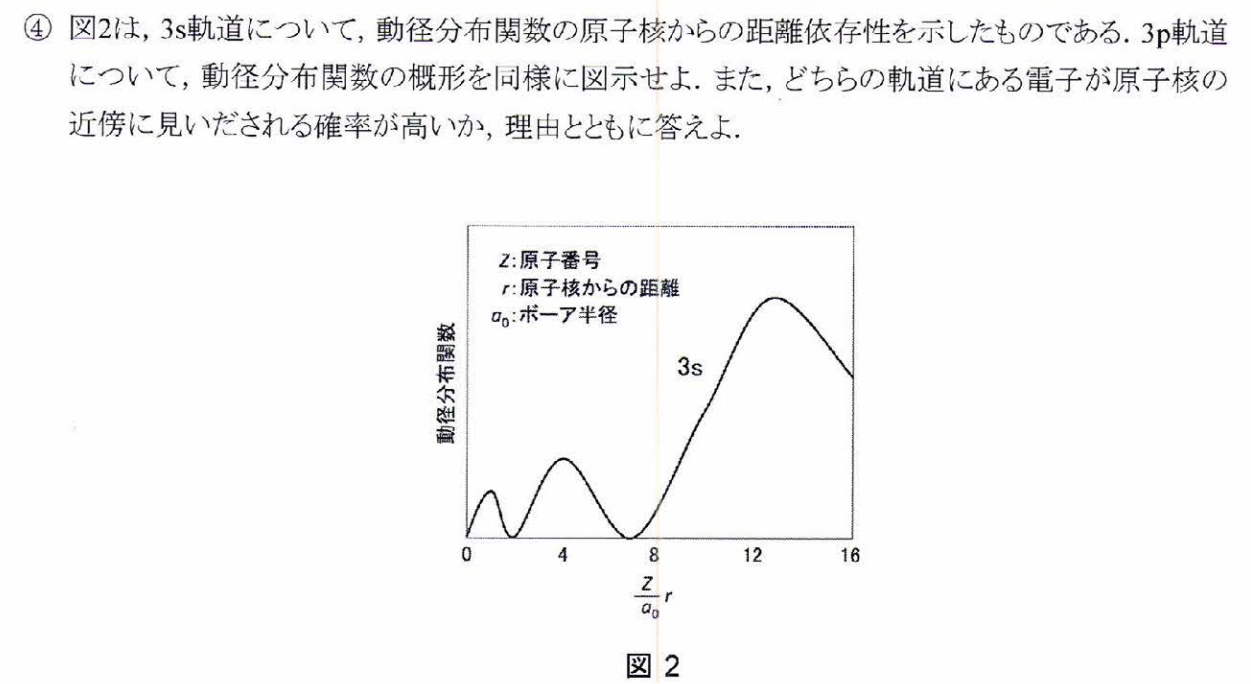
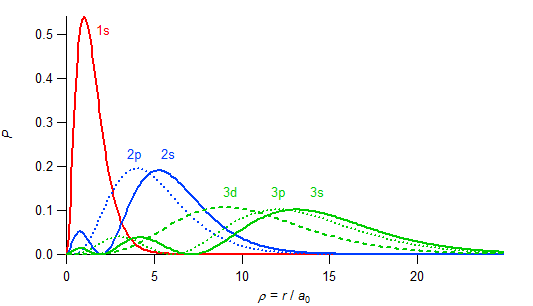
2p軌道のほうが平均としては核に近いが、2s軌道の電子は内殻に極大があるため核の近くにいる確率は2s軌道の電子のほうが高くなる。
参考)http://www.che.kyutech.ac.jp/chem13/kyutech-only_old/muki1Brei/muki1Bre.html
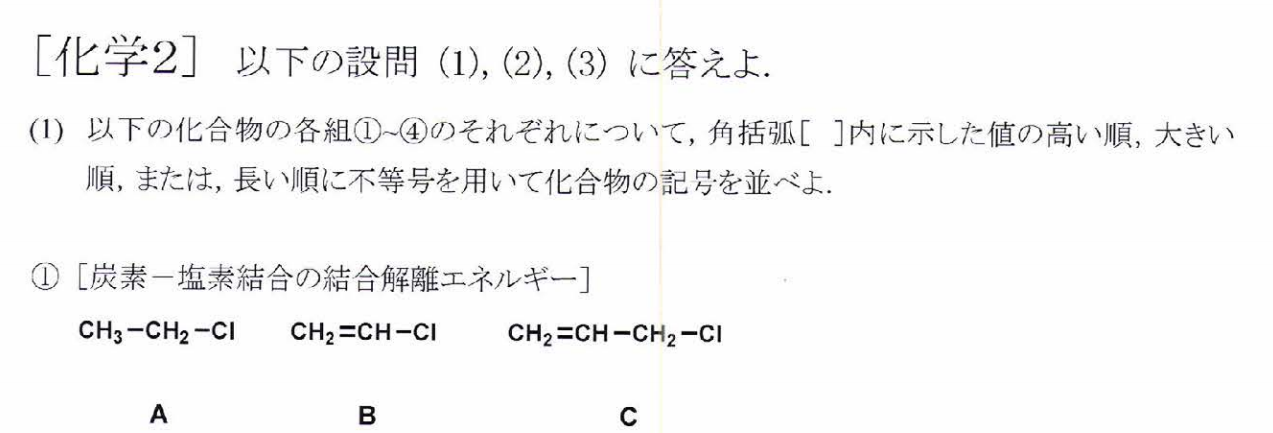 B>A>C
B>A>C
参考)https://en.wikipedia.org/wiki/Carbon%E2%80%93hydrogen_bond
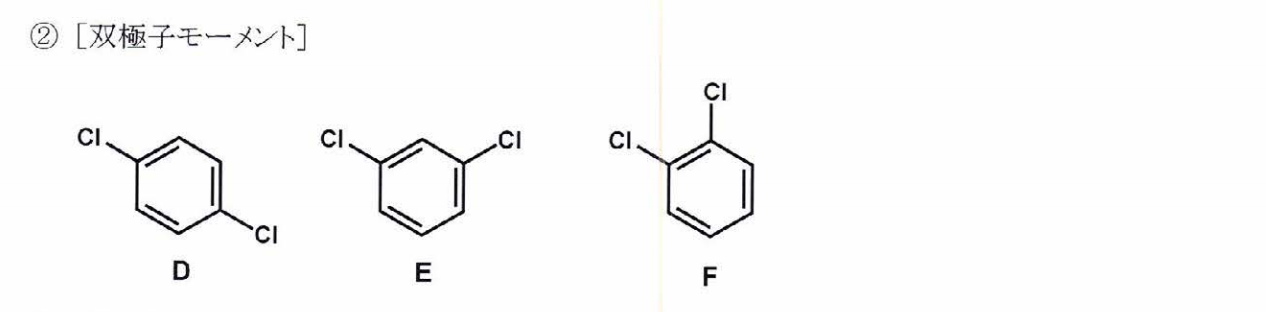 F>E>D
F>E>D
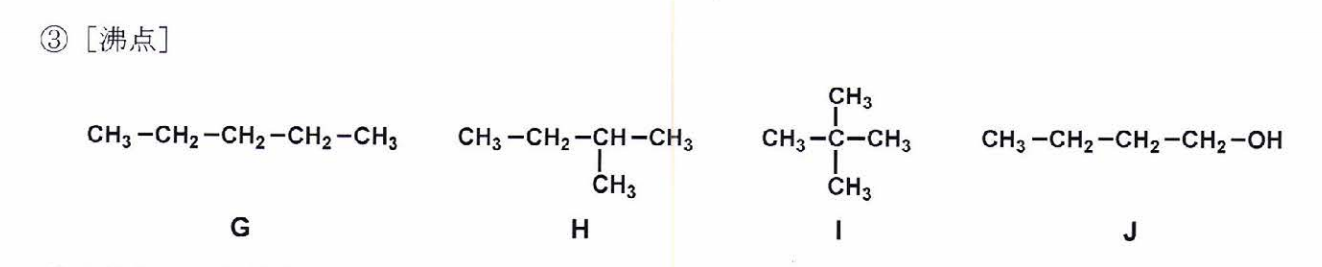 J>G>H>I
J>G>H>I
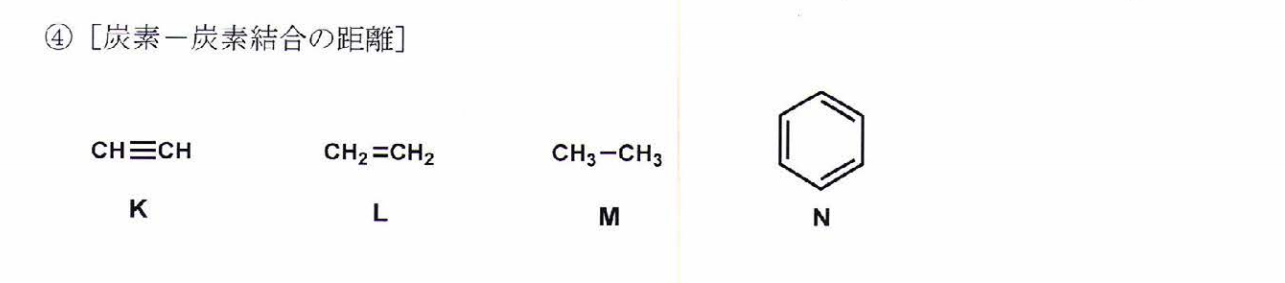
M>N>L>K

 ①トルエン・クロロベンゼン・フェノール
①トルエン・クロロベンゼン・フェノール
②トルエン・フェノール
③ニトロベンゼン
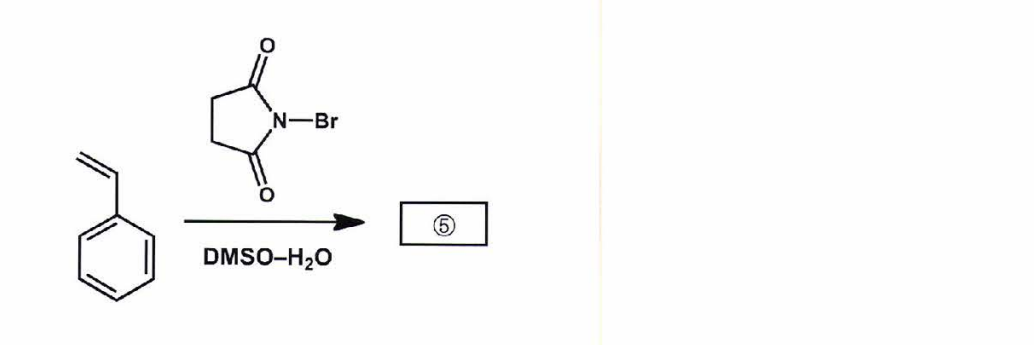
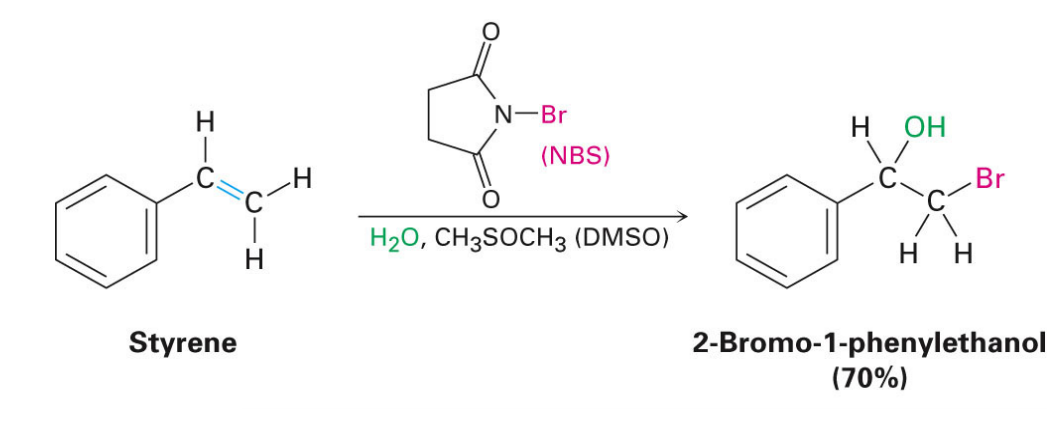 画像引用)http://www.ashleypiekarski.net/teaching/Chapter8.pdf
画像引用)http://www.ashleypiekarski.net/teaching/Chapter8.pdf
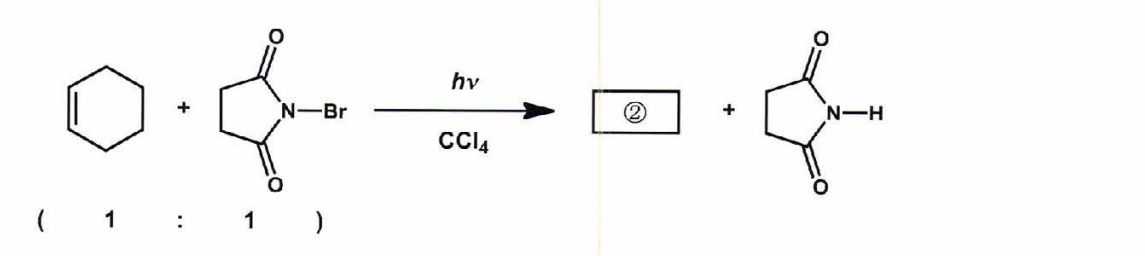
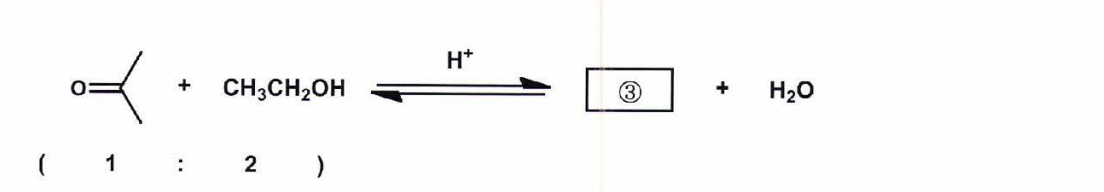
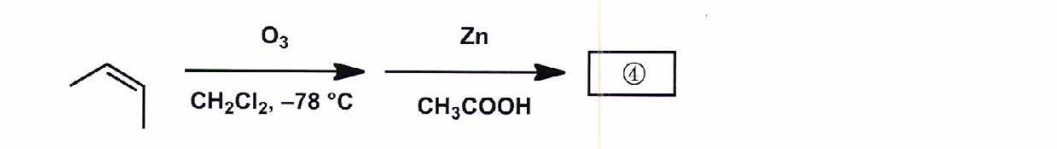
 ①
①