 (a)供与体 (b)受容体 (c)酸 (d)塩基(e)共役塩基 (f)$\rm Cl^-$
(a)供与体 (b)受容体 (c)酸 (d)塩基(e)共役塩基 (f)$\rm Cl^-$
 アクア化
アクア化
 $\rm Ti^{3+}$や$\rm Al^{3+}$は正電荷数が大きく、またイオン半径が小さいので、配位している水の負電荷を持つ酸素を強くひきつけ、正電荷であるプロトンと強く反発する。そのためプロトンが解離しやすくなり、ブレンステッド酸としての性質が生じる。
$\rm Ti^{3+}$や$\rm Al^{3+}$は正電荷数が大きく、またイオン半径が小さいので、配位している水の負電荷を持つ酸素を強くひきつけ、正電荷であるプロトンと強く反発する。そのためプロトンが解離しやすくなり、ブレンステッド酸としての性質が生じる。
※このような酸を「アクア酸」といいます。詳しくはアクア酸をご参照ください。
 \begin{eqnarray}
\begin{eqnarray}
\rm γ-Al_2O_3+3H_2O+6H_3O^{+}&→&\rm 2[Al(OH_2)_6]^{3+} \\
\rm γ-Al_2O_3+3H_2O+2OH^{-}&→&\rm 2[Al(OH)_4]^{-} \\
\end{eqnarray}
※両性酸化物・両性水酸化物についてはこちらにも書きました。
 \begin{eqnarray}
\begin{eqnarray}
\rm AgCl&→&\rm Ag^{+}+Cl^{-} \\
K_{\rm sp}&=&\rm [Ag^+][Cl^-] \\
水に溶解したとき、\rm [Ag^+]&=&[Cl^-]=1.33×10^{-5}なので \\
K_{\rm sp}&=&\s{1.33×10^{-5}}^2 \\
&=& 1.77×10^{-10}[\rm mol^2・L^{-2}]\\
よって&、&\rm HClへの溶解度は\\
K_{\rm sp}&=&\rm [Ag^+][Cl^-] \\
1.77×10^{-10}&=&\rm [Ag^+]×1.00×10^{-2}\\
\rm [Ag^+]&=&1.77×10^{-8}\\
であるため&,&溶解度は\rm [Ag^{+}]と等しいから\\
1.77&×&10^{-8}\rm [mol・L^{-1}]\\
\end{eqnarray}
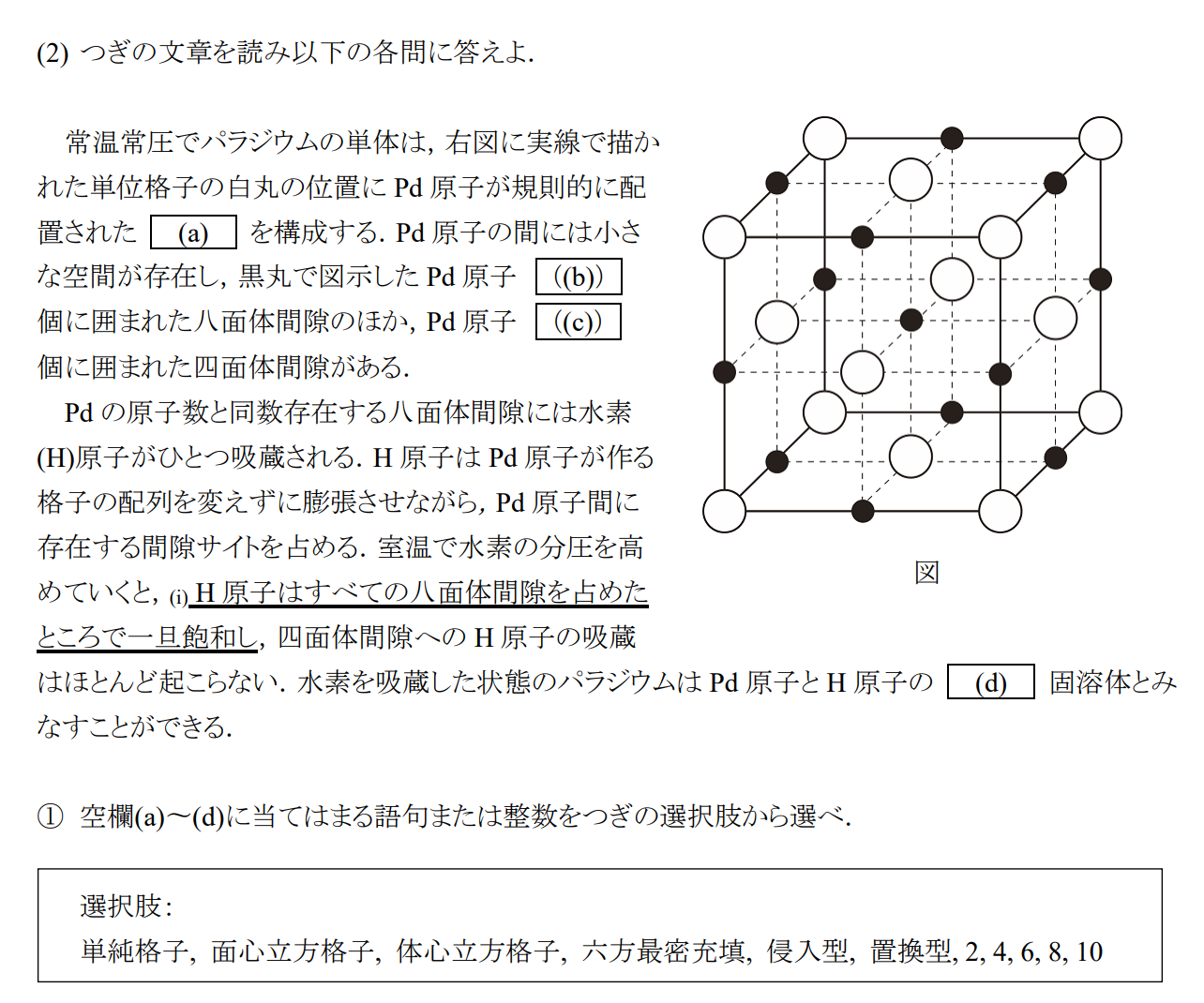 (a)体心立方格子 (b)6 (c)4 (d)侵入型
(a)体心立方格子 (b)6 (c)4 (d)侵入型
 \begin{eqnarray}
\begin{eqnarray}
吸蔵された水素原子の物質量は&,& \\
\f{1.06}{106}&=& 1.0×10^{-2}{[\rm mol]}\\
よって&、&吸収された水素分子の物質量は\\
\f12×1.0×10^{-2}&=&5.0×10^{-3}{[\rm mol]} \\
\end{eqnarray}
 $\rm NaCl$のみ
$\rm NaCl$のみ
 四面体間隙のほうが八面体型間隙よりも狭く、ヒドリドとして吸蔵される水素原子はイオン半径が大きく、入ることができないため。
四面体間隙のほうが八面体型間隙よりも狭く、ヒドリドとして吸蔵される水素原子はイオン半径が大きく、入ることができないため。
※水素が金属に吸蔵される場合、それはプロトン$\rm H^+$としてではなく、ヒドリド$\rm H^-$として吸蔵されます。その根拠としては、侵入型合金の伝導性や磁性の減少(つまり、金属の自由電子を水素原子がもらい、$\rm H^-$の状態になることで伝導性や磁性が減少する。)、金属格子の膨張(プロトンだと金属格子は縮小する)、計算化学からの知見(7族の金属にヒドリドが吸蔵される場合、計算によればそれは不安定になる。そして実際に7族の侵入型合金は未発見で、計算結果に合う)などがあります。


立体障害の大きいメチル基がそれぞれエクアトル位につく配置が最も安定である。アキシアル位につくと水素と1.3ジアキシアル相互作用を起こし、反発するため、不安定となる。

 マレイン酸は分子間水素結合を形成し分子間相互作用が弱いのに対して、フマル酸は分子間水素結合を形成し、分子間相互作用が強いため。
マレイン酸は分子間水素結合を形成し分子間相互作用が弱いのに対して、フマル酸は分子間水素結合を形成し、分子間相互作用が強いため。

①
②
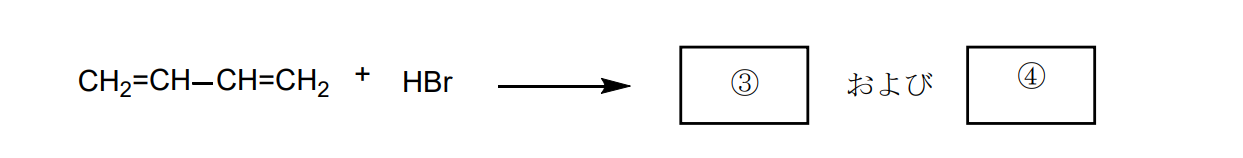
※カルボカチオンの中間体において、
上は1置換アルケンで、2級カルボカチオン、
下は2置換アルケンで、1級カルボカチオンです。
2級カルボカチオンのほうが1級カルボカチオンより速度論的に安定ですが、
2置換アルケンは1置換アルケンよりも熱力学的に安定です。
そのため、温度などにより生成する割合が変化すると考えられます。

⑤
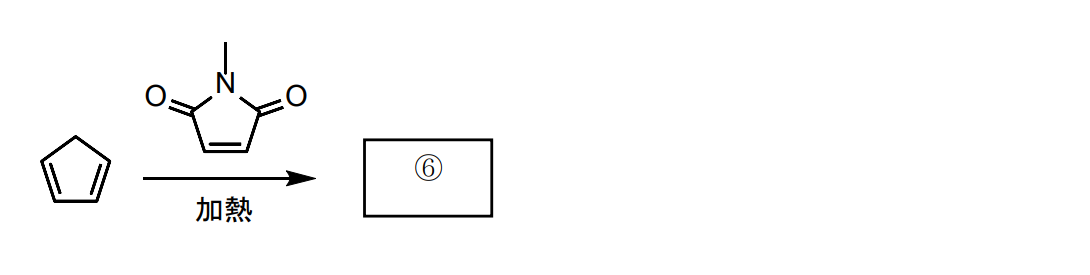 ⑥
⑥
endo体が形成されます。詳しくはディールズアルダー反応をご参考ください。