 $\rm [Cr(H_2O)_6]^{3+}:中心金属の酸化数は+3:d電子数は3$
$\rm [Cr(H_2O)_6]^{3+}:中心金属の酸化数は+3:d電子数は3$
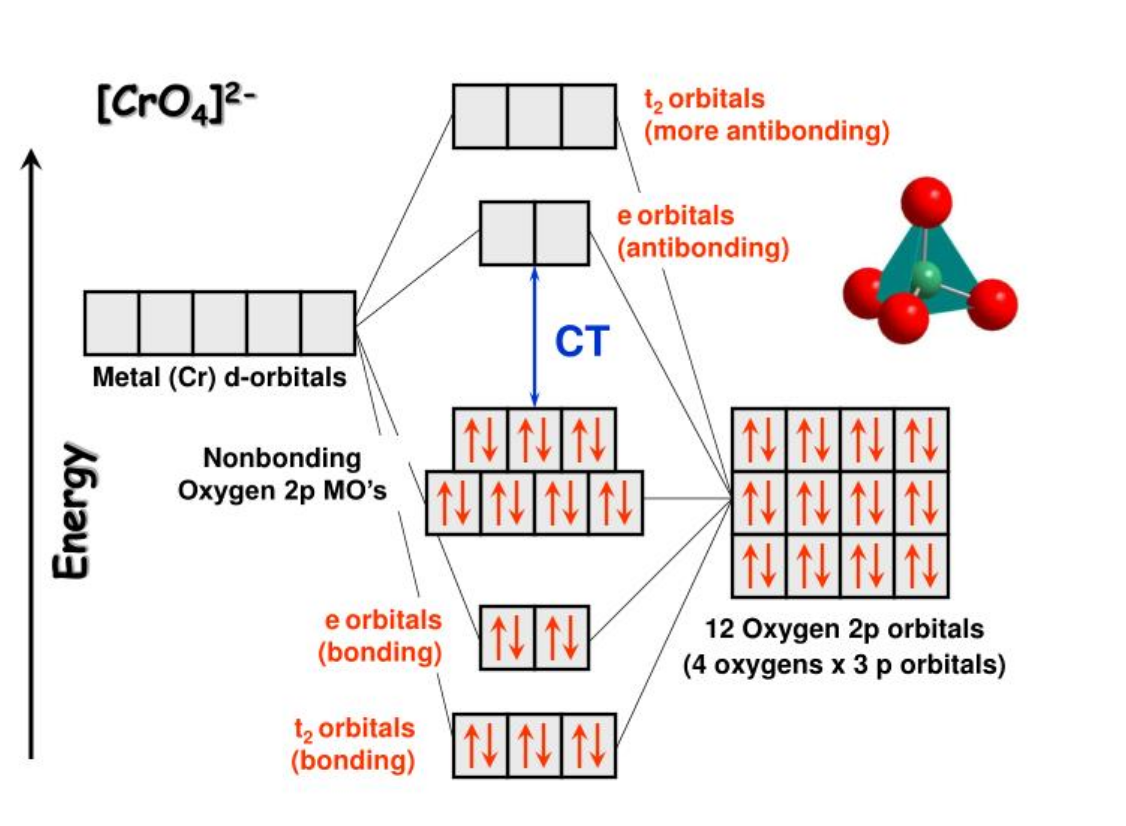
$\rm [CrO_4]^{2-}:中心金属の酸化数は+6:d電子数は0$
※d電子数はその中心金属の族番号から酸化数を引いたものになります。
 $\rm Cr(H_2O)_6^{3+}$は$\rm d^3$の電子配置を取り、光を吸収した際、d-d遷移を起こす。しかし、このd-d遷移はラポルテ禁制あるため吸光強度が小さくなる。一方、$\rm [CrO_4]^{2-}$はLMCT遷移を起こす。配位子には奇関数の軌道もあるため、LMCT遷移はラポルテ許容の遷移が存在し、吸光強度が大きくなる。
$\rm Cr(H_2O)_6^{3+}$は$\rm d^3$の電子配置を取り、光を吸収した際、d-d遷移を起こす。しかし、このd-d遷移はラポルテ禁制あるため吸光強度が小さくなる。一方、$\rm [CrO_4]^{2-}$はLMCT遷移を起こす。配位子には奇関数の軌道もあるため、LMCT遷移はラポルテ許容の遷移が存在し、吸光強度が大きくなる。
※d-d遷移はd軌道どうしの間で原則的にスピンの変化を伴わず起こります。一方、電荷移動遷移のうち、配位子Lの基小津が主な成分である軌道から金属Mの軌道が主な成分である軌道への遷移を配位子ー金属電荷遷移(LMCT)とよびます。また、金属Mの基小津が主な成分である軌道から配位子Lの軌道が主な成分である軌道への遷移を、金属ー配位子電荷移動(MLCT)と呼びます。電子遷移は偶関数の軌道と奇関数の軌道の間で起こり、偶関数から偶関数への軌道への遷移およぶ奇関数の軌道から奇関数の軌道への遷移は禁制とされています。これをラポルテ禁制とよびます。八面体六配位錯体のd軌道の間で起こるd-d遷移はラポルテ禁制となるため、遷移が起こりにくく、モル吸光係数が小さいです。一方、四面体型錯体のd軌道は対称中心を持たないので、d-d遷移がラポルテ禁制とならないためモル吸光係数は比較的大きいです。また、配位子は$\rm t_{1u}$などの奇関数の軌道があるため、LMCTやMLCTではラポルテ許容の遷移が存在するため吸光係数が非常に大きくなります。モル吸光係数の大きさに関しては、六配位八面体型錯体のd-d遷移では大きくともだいたい$\rm 100dm^3mol^{-1}cm^{-1}$程度までですが、対称中心を持たない四面体型錯体でも$\rm 500dm^3mol^{-1}cm^{-1}$以下であるのに対して、電荷移動遷移は$\rm 1000~50000dm^3mol^{-1}cm^{-1}$と100倍ほど強くあらわれます。
図引用)https://www.slideserve.com/mathilde/molecular-orbital-theory-and-charge-transfer-excitations
$[CrO_4]^{2-}$は四面体型錯体であるため、軌道は$t_2$と$e$です。これからもd電子数が0であることがわかります。
 平面六角形のシート構造がファンデルワールス力により積層した構造を持つ。C原子は$sp^2$混成をとっている。
平面六角形のシート構造がファンデルワールス力により積層した構造を持つ。C原子は$sp^2$混成をとっている。
 C原子は$sp^3$混成をとり、正四面体が無限につながった構造を取る。
C原子は$sp^3$混成をとり、正四面体が無限につながった構造を取る。
 $\rm C_{60}$は切頭二十面体構造をとり、C原子は$sp^2$混成軌道をとっている。そのため、非常に高い歪みを持つ。
$\rm C_{60}$は切頭二十面体構造をとり、C原子は$sp^2$混成軌道をとっている。そのため、非常に高い歪みを持つ。
 $\rm CO_2$は気体、$\rm SiO_2$は固体である。$\rm CO_2$の炭素周りの結合は$sp$混成であり、直線系である。また、$\rm SiO_2$のケイ素は$sp^3$混成であり、ケイ素原子を中心とする正四面体構造が酸素原子を介して無数に連なる構造をしている。
$\rm CO_2$は気体、$\rm SiO_2$は固体である。$\rm CO_2$の炭素周りの結合は$sp$混成であり、直線系である。また、$\rm SiO_2$のケイ素は$sp^3$混成であり、ケイ素原子を中心とする正四面体構造が酸素原子を介して無数に連なる構造をしている。
二酸化炭素の構造
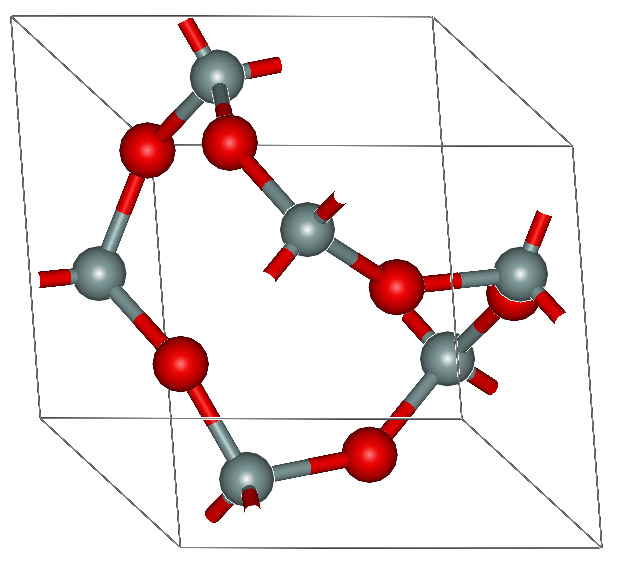
二酸化ケイ素の構造
 $\rm C=O$結合二本分の結合エンタルピーは$806×2=1612{[\rm kJ/mol]}$
$\rm C=O$結合二本分の結合エンタルピーは$806×2=1612{[\rm kJ/mol]}$
で、$\rm C-O$結合四本分の結合エンタルピーの$359×4=1436{[\rm kJ/mol]}$
より大きい。
また、$\rm Si-O$結合四本分の結合エンタルピーは$466×4=1864{[\rm kJ/mol]}$で、$\rm Si=O$結合二本分の結合エンタルピーの$642×2=1284{[\rm kJ/mol]}$よりも大きい。そのため、以上のような構造を取ると考えられる。