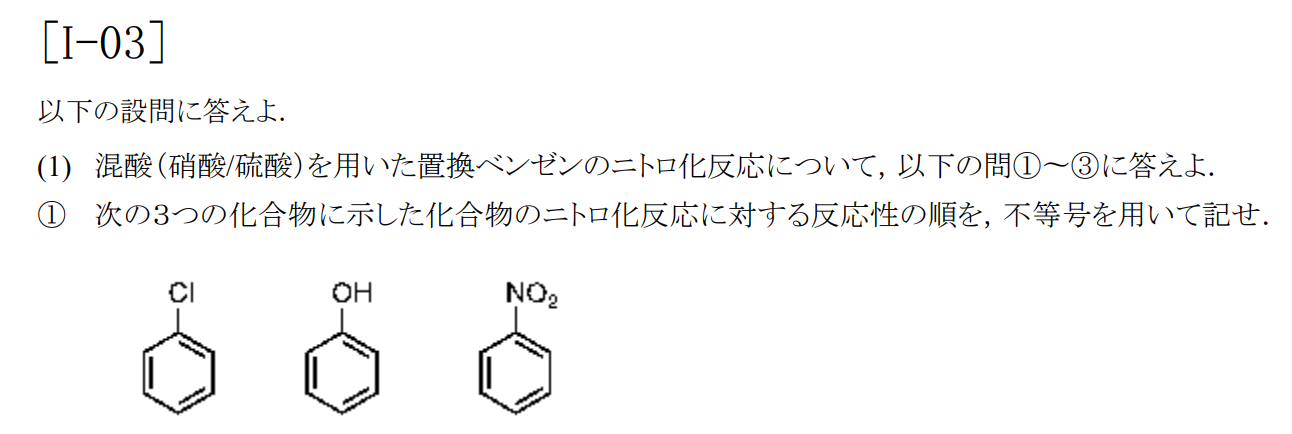

酸条件下では、活性化基であるニトロ基$\rm -NH_2$がプロトン化して不活性化基の$\rm -NH_3^+$になるため。
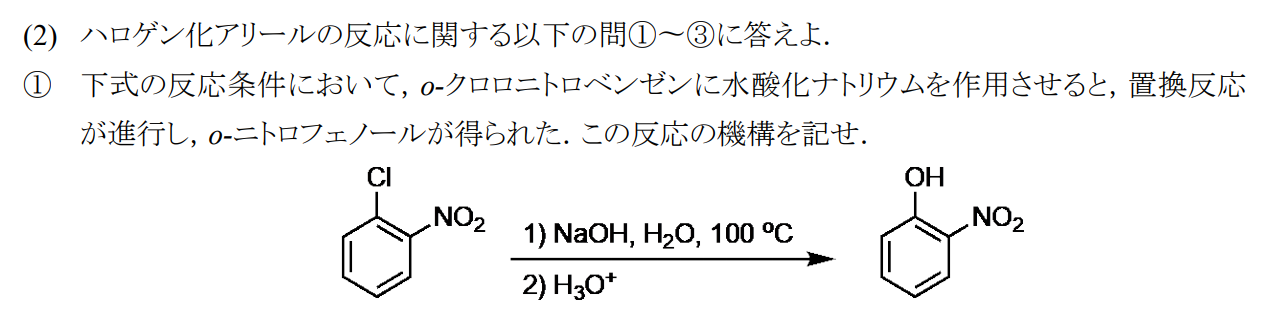
※求核付加反応の付加脱離反応です。ニトロ基などの電子求引基によって求核攻撃が促進され、かつ中間体アニオンも安定化されるときに起こります。

m-クロロニトロベンゼンの場合、OHが求核攻撃した後の中間体アニオンの負電荷がN原子に非局在化しにくく、オルト位やパラ位にアミノ基がある場合よりも中間体アニオン安定化されないため、①と同じ条件では反応しない。
 (a)
(a)
アとイは順不同可で以下の化合物です。
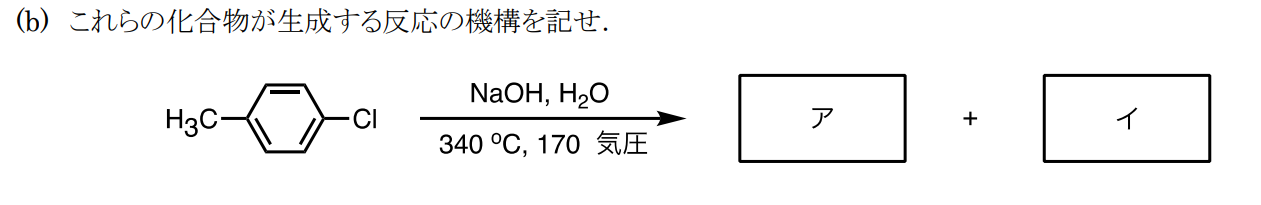
求核攻撃でも①と違い、求核置換の脱離付加反応です。ベンザイン中間体を経由するため、生成物は混合物となります。
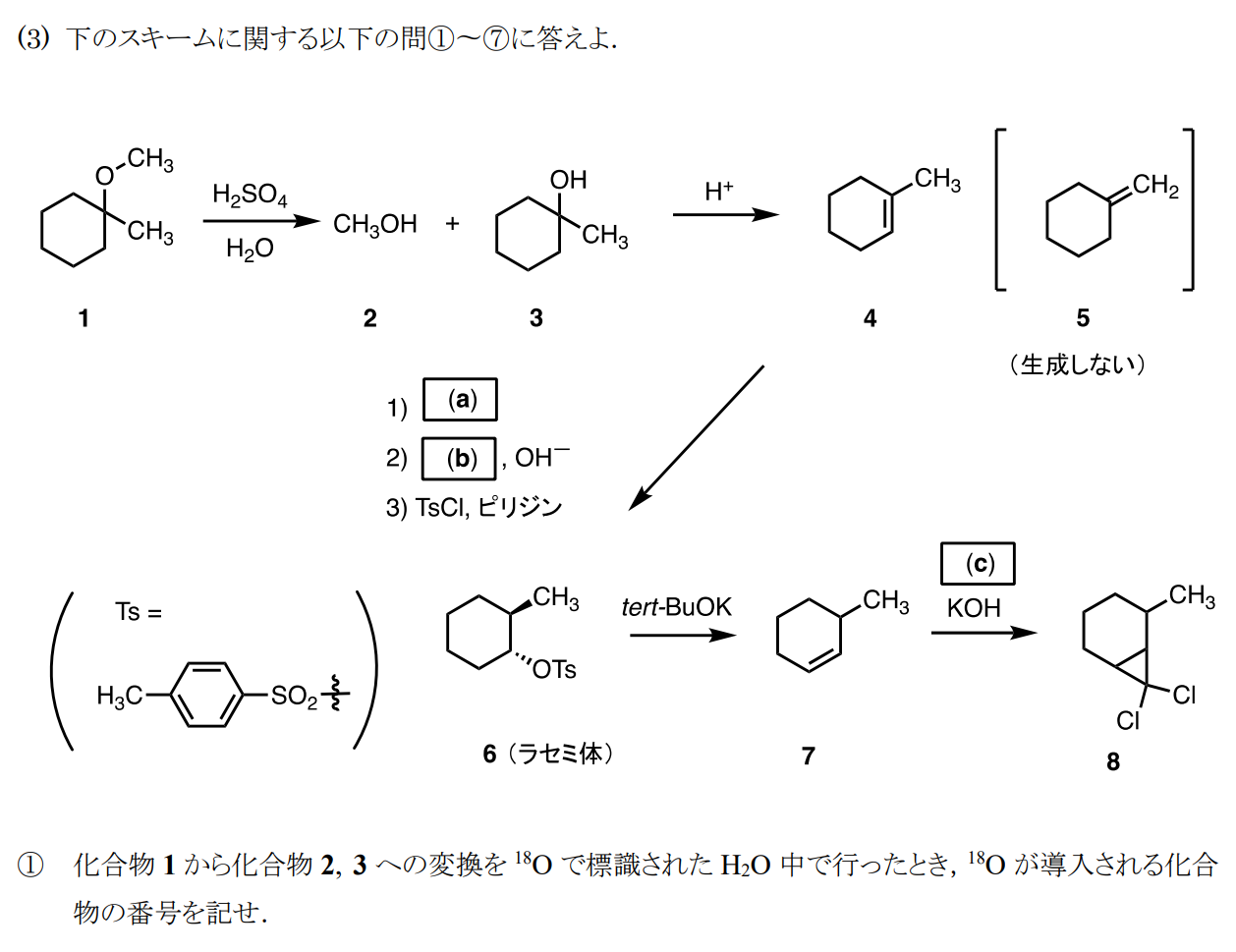 3番です。
3番です。
 第1級アルコールのほうがプロトンが解離して共役塩基になったときに、電子供与基のアルキル基の数が少ないため、不安定化される度合いが小さい。そのため2のほうが3よりpKaが大きくなる。
第1級アルコールのほうがプロトンが解離して共役塩基になったときに、電子供与基のアルキル基の数が少ないため、不安定化される度合いが小さい。そのため2のほうが3よりpKaが大きくなる。
 超共役とは、空のπ結合と、隣接するC-Hのσ結合との間の安定化相互作用である。そのため、置換基が多いアルケンほど安定化する。
超共役とは、空のπ結合と、隣接するC-Hのσ結合との間の安定化相互作用である。そのため、置換基が多いアルケンほど安定化する。
 ヒドロホウ素化酸化です。
ヒドロホウ素化酸化です。
(a)$\rm BH_3$
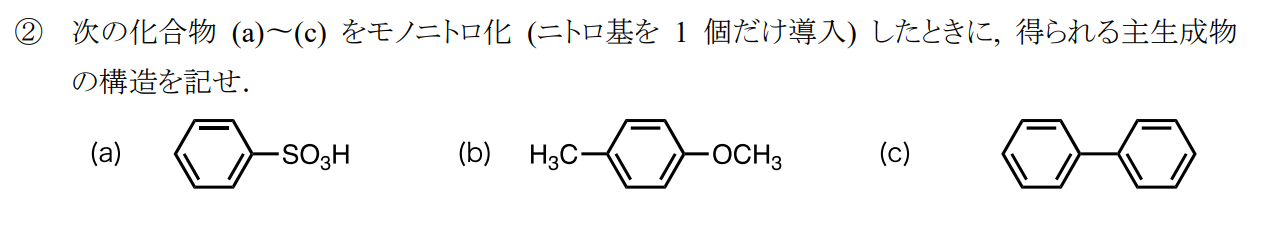 (a)
(a)
 (c)$\rm CHCl_3$
(c)$\rm CHCl_3$