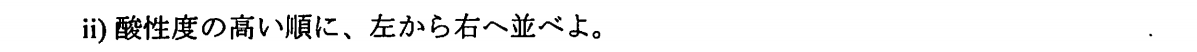$$\rm BBr_3>BCl_3>CF_3$$
これらの分子は平面三角形構造であり、ハロゲン原子の$np$軌道はホウ素の空の$2p$軌道と$π$結合を形成する。$\rm BX_3$がLewis酸として働く時、例えば、$\rm N(CH_3)_3$のようなLewis塩基と反応して、$\rm XB_3-N(CH_3)_3$となるような時、これらの$π$結合が切れて、ホウ素まわりは四面体構造へと変化する。$π$結合形成には、Fは$2p$軌道、Clは$3p$軌道、Brは$4p$軌道を用いる。ホウ素の2p軌道と最も重なりが良いのは2p軌道を用いるF原子なので、最も強い$π$結合をつくる$\rm BF_3$は付加体をつくりにくく、Lewis酸として最も弱くなる。
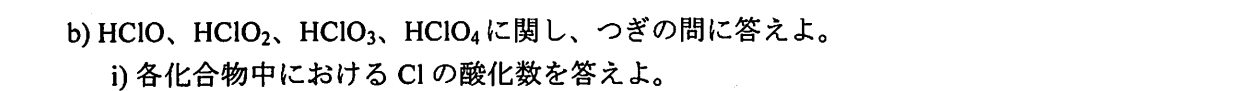
\begin{eqnarray}
\rm HClO&:&+1 \\
\rm HClO_2&:& +3\\
\rm HClO_3&:&+5 \\
\rm HClO_4&:+7& \\
\end{eqnarray}
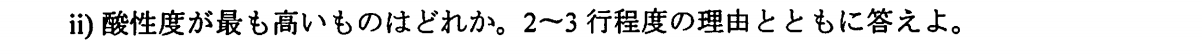
$\rm HClO_4$
酸素原子は電気陰性度が低いため、塩素と結合する酸素原子の個数が多ければ多いほど電子を引き寄せて、O-H結合を弱くする。よって、プロトンの放出が容易になるので、酸性度が増大する。