重水$\rm D_2O$の製造法の流れの一つに、
$$\rm Girdler-Spevack法(GSプロセス)(数%~20%程度)\\↓\\分別蒸留(~90%程度)\\↓\\電気分解(99.8%程度) $$の三段階で濃縮するというものがあります。
Girdler-Spevack法(ガードラー・スペバック法、GSプロセス)
Girdler-Spevack法では
$$\rm H_2O({\rm g})+HDS({\rm l}) \ \mathop{\rightleftharpoons}^{低温}_{高温} \ HDO({\rm g})+H_2S({\rm l}) $$
という、重水素交換反応の平衡定数が温度により異なることを利用しています。この重水素交換反応は30℃で$K=2.33$、130℃で$K=1.82$となります。つまり、低温では硫化水素の重水素の一部が水に移り、高温では水の重水素の一部が硫化水素に移るということです。
このサイクルを以下の図のような低温塔と高温塔を接続したプラントをいくつも経由することにより水に含まれる重水素の割合を高めていきます。
このような重水濃縮方法を二重温度交換法といいます。
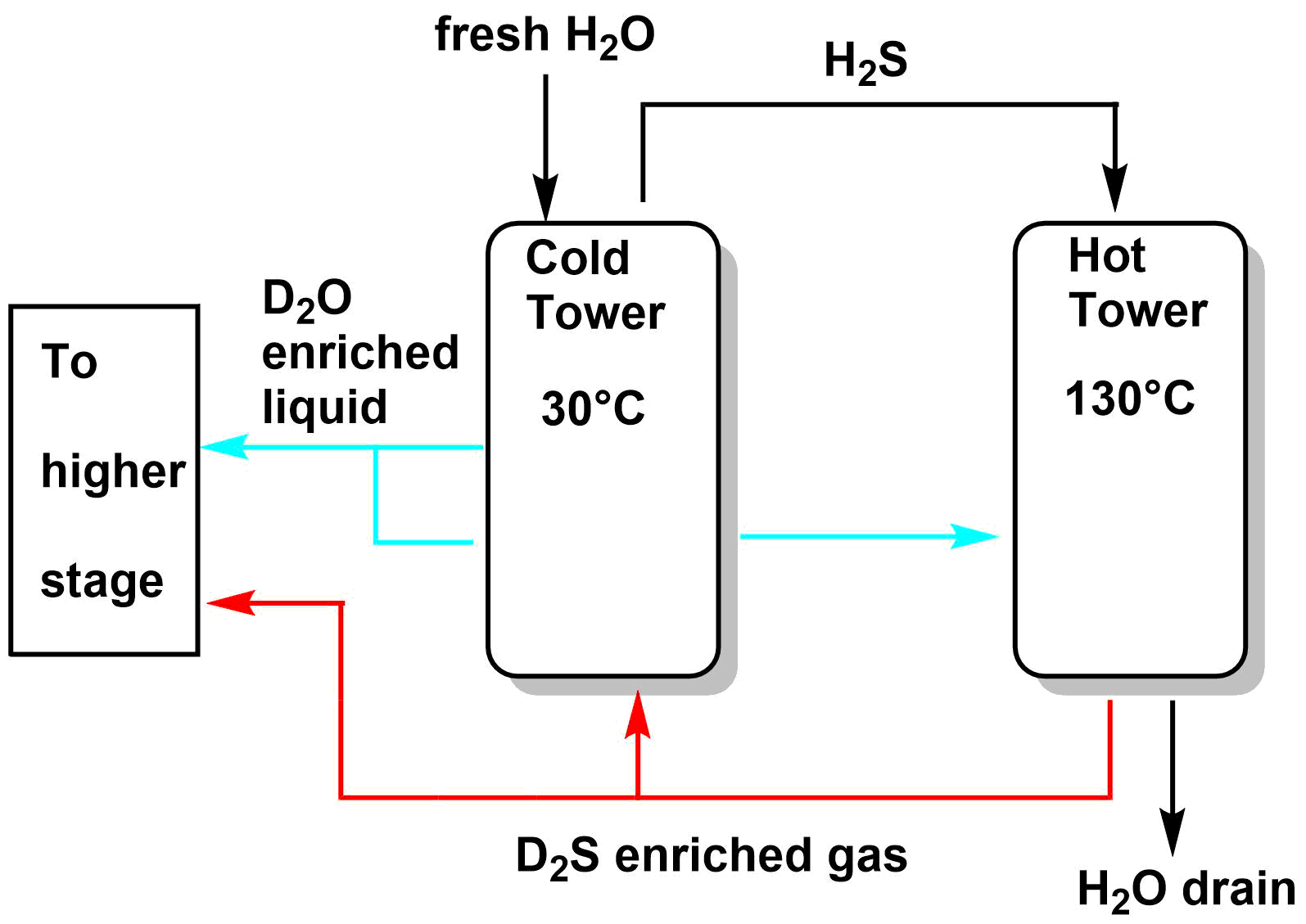
という反応サイクルを繰り返し、重水濃度を数%~20%ほどに濃縮します。1トンの重水を作るのに、数十万トンの水の供給が必要です。
分別蒸留
Girdler-Spevack法などである程度濃縮された重水は分別蒸留により更に濃縮されます。重水の沸点は軽水に比べて1.4℃ほど高いため、分別蒸留により$\rm D_2O$の純度を~90%程度まで濃縮することができます。
電気分解
分別蒸留の後、90%以上のさらなる純度の重水を得たい場合は電気分解をします。
水(軽水)と重水の混合溶液を電気分解すると、
$$\rm H_2O→H_2+\f12O_2\\
D_2O→D_2+\f12O_2$$という2つの反応が起こりますが、軽水の方が電気分解されやすいので、電気分解を続けていくと、重水が濃縮されていきます。この電気分解では99.8%程度まで重水が濃縮されます。