
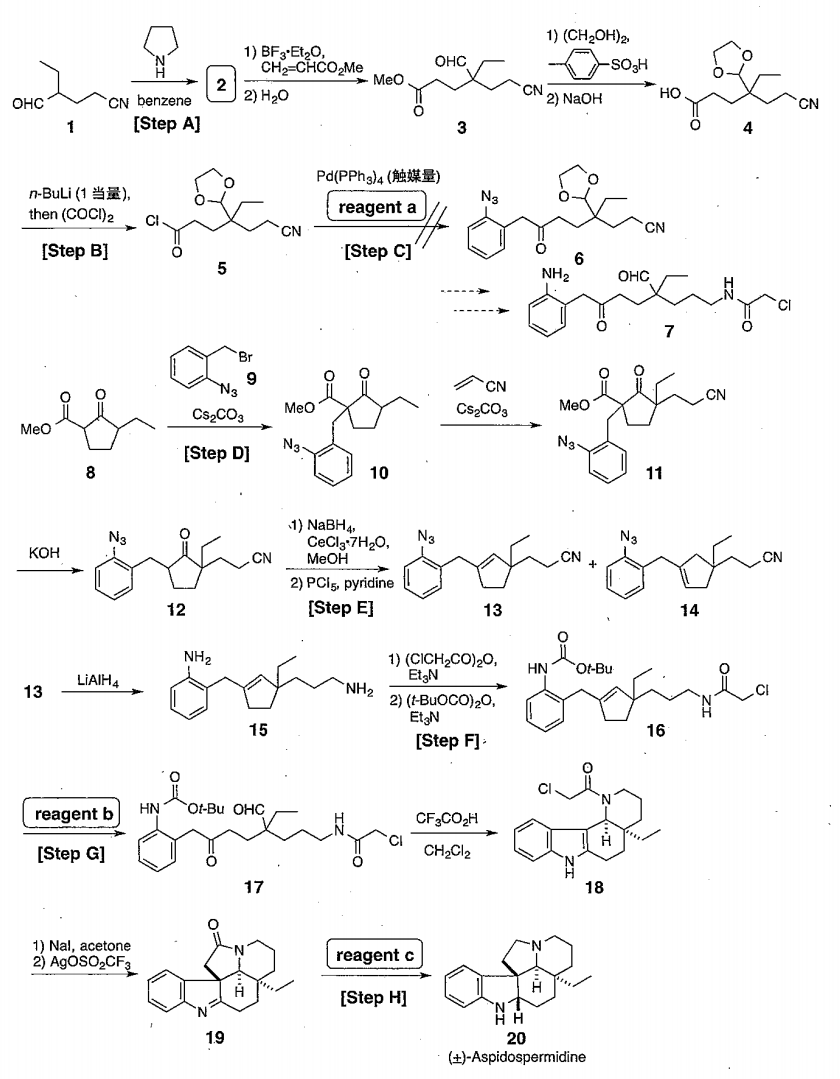

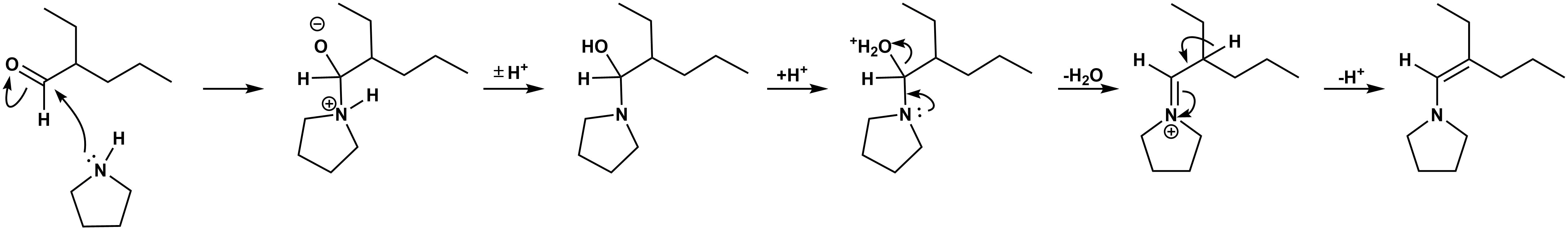
これはエナミンの生成です。この反応機構のなかで水の脱離が伴います。そのため反応混合物から水を除去するDean-Stark装置が必要です。

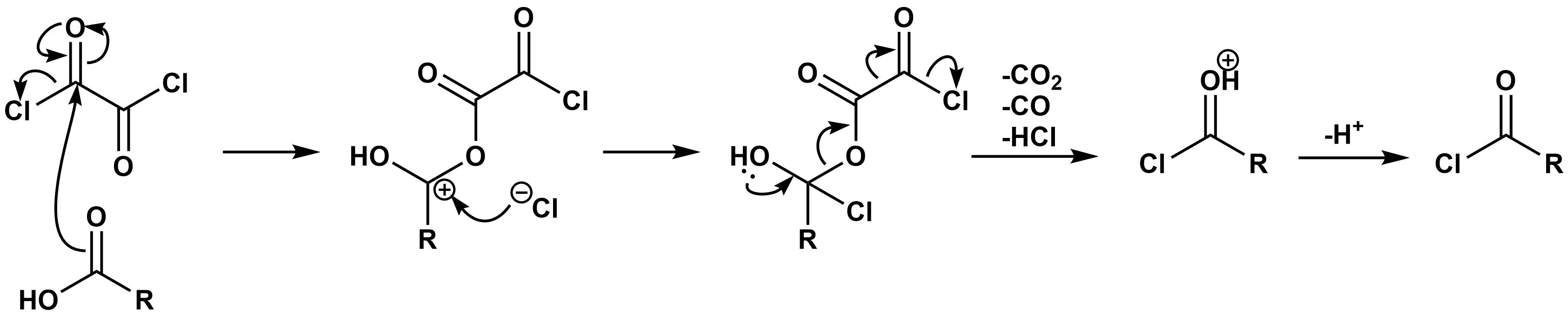
塩化オキサニルによる酸塩化物の合成は以上のような反応機構になります。ただし、塩化チオニルや塩化オキサニルによる酸塩化物の合成では通常DMFが触媒として加えられます。まず、DMF塩化チオニルや塩化オキサニル反応し、Vilsmeier試薬になり、そのVilsmeier試薬とカルボン酸が反応することで、酸塩化物ができるとともに、DMFが回復します。この問題ではそこまで問われていませんが、東工大では過去に出題されています。
参考)
豊田 真司「有機化学演習Ⅲ」p199 (塩化チオニル)
こちらの記事も参考にさせていただきました。

※
この問題ではうまくいきませんでしたが、このような有機金属化合物とハロゲン化物とを反応させてC-C結合をつくる反応をクロスカップリング反応といいます。
特に、$R-MX$で$\rm M=B,Mg,Sn,Zn$の有機金属化合物を用いるPd触媒反応は重要で、それぞれ発見者の名前で呼ばれています。$\rm B$は鈴木カップリング、$\rm Mg$は熊田ー玉尾ーCorriuカップリング、そして、この問題の$\rm Zn$は根岸カップリングです。

反応点は酸性度の高いα水素の$\rm H_1,H_2$の2つが考えられるが、$\rm H_1$の方がカルボニル基が2つ隣接しており$\rm H_2$より酸性度が高いため$\rm H_1$が優先して脱離する。そのため化合物10のみが生成する。
 ※一応考えてみました。
※一応考えてみました。
カルボニル基がヒドロキシ基に還元されて、そのあと、ヒドロキシ基が塩素化され、その塩素が脱離して13が生じたのち、反応系に存在するプロトンが再びアルケン部分に求電子攻撃を行った後、第三級カルボカチオンになり、そこが塩素化され、またその塩素が脱離し、当確率で13と14になるため。
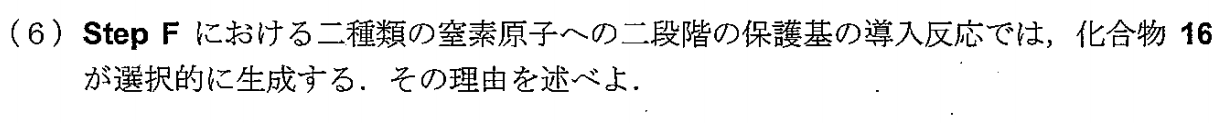
※あっているかはわかりませんが、考えてはみました。
アニリンはベンゼン環にアミノ基窒素の非共有電子対を供与しており、電子密度が低くなるため、塩基性が通常のアミンよりも低くなる。そのため、保護基が1当量であった場合、優先的にアミンと反応するため。

オゾン開裂だと思われます。
$\rm O_3,Me_2S$
$\rm NaBH_4$だと思います。