H29の応用化学系の全問はこちら

①$sp^3$混成 ②大きい ③グラフェン ④$sp^2$混成 ⑤3 ⑥π ⑦カテネーション
⑧不純物半導体(単に「半導体」と書いても可であると思います。)
 (a)同素体
(a)同素体
(b)フラーレン、カーボンナノチューブ、不定形炭素などから一つ答える。
 単位格子中に炭素は8個存在する。また、密度は
単位格子中に炭素は8個存在する。また、密度は
$\f{8×12}{({3.6×10^{-8}})^3×6.0×10^{23}}=3.42{[\rm g・cm^{-3}]}$
となる。
 仮に等温過程でこの反応が進行するとすると、$\d G=V\d p$になるので、グラファイトの密度とダイヤモンドの密度がわかればダイヤモンド合成に必要な圧力は求めることができる。計算の結果,かなりの高圧が必要になることがわかる。
仮に等温過程でこの反応が進行するとすると、$\d G=V\d p$になるので、グラファイトの密度とダイヤモンドの密度がわかればダイヤモンド合成に必要な圧力は求めることができる。計算の結果,かなりの高圧が必要になることがわかる。
 ブラックの式$2d\sinθ=nλ$より$θ$はdが増加すると減少する。
ブラックの式$2d\sinθ=nλ$より$θ$はdが増加すると減少する。
 二酸化炭素のC原子は$sp$混成軌道、O原子は$sp^2$混成軌道をとり、また、二酸化ケイ素のSiとO原子はともに$sp^3$混成を取る。よって、結合字数は前者は2になり、後者は1になる。よって、構造に違いが生じる。
二酸化炭素のC原子は$sp$混成軌道、O原子は$sp^2$混成軌道をとり、また、二酸化ケイ素のSiとO原子はともに$sp^3$混成を取る。よって、結合字数は前者は2になり、後者は1になる。よって、構造に違いが生じる。
 太陽電子に光を当てると、pn接合の場合、電子がp型半導体からn型半導体へ移り、ホールは逆に動く。これが回路に電気の流れを引き起こし、電池として機能する。
太陽電子に光を当てると、pn接合の場合、電子がp型半導体からn型半導体へ移り、ホールは逆に動く。これが回路に電気の流れを引き起こし、電池として機能する。
また、半導体のバンドギャップを狭めることによって、より低いエネルギーの光も利用することができる効果が期待できる。

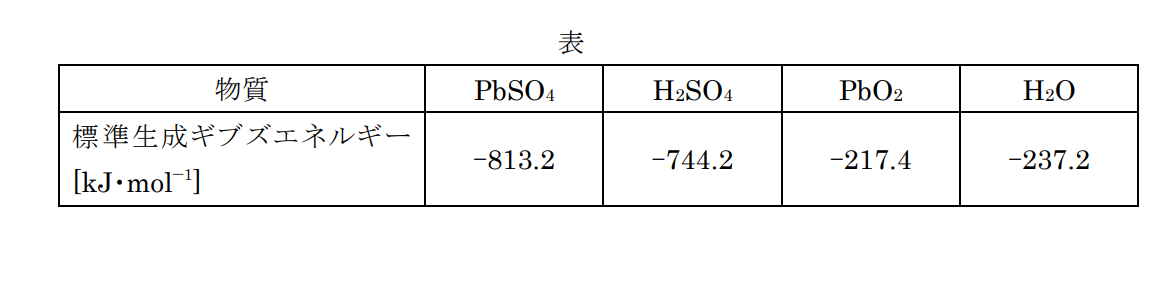 鉛蓄電池の全反応式は
鉛蓄電池の全反応式は
$\rm Pb+PbO_2+2H_2SO_4⇄2PbSO_4+2H_2O$
となる。左辺の標準生成ギブズエネルギーは$-217.4+(-744.2)×2=-1705.8[{\rm kJ/mol}]$で、右辺の標準生成ギブズエネルギーは$(-813.2)×2+(-237.2)×2=-2100.8{[kJ/mol]}$
であるので、放電反応は右辺から左辺である。
$\rm Pb+PbO_2+2H_2SO_4→2PbSO_4+2H_2O$
また、鉛蓄電池の起電力は
$E=-\f{(-2100.8-(-1705.8))×1000}{2×9.65×10^{4}}=2.04[{\rm V}]$
よって、起電力が水の分解電圧である1.23Vよりも大きいため、充電する際に水が電気分解されてしまうが、それを排気したり、水に戻すことで実用化している。