まず初めに
SN1, SN2,E1,E2の反応性を左右する要因は以下の4つです。
|
①基質(substate)の置換様式 ②脱離基 ③反応試薬 ④溶媒 |
今回はSN2反応における上記4つの要因に関してメモしていく。
そもそもSN2反応とは?
SN2反応は[substitution(置換) nucleophilic(求核的) bimolecular(2分子)]の略で、文字通り、2つの分子の濃度が(ここでは基質と求核試薬)反応速度に関与するいわゆる二次反応である求核置換反応です。
反応速度に関与するのは2分子ですが、反応自体は中間体を経由しない1段階反応です。求核試薬が脱離基のちょうど反対側から基質に求核攻撃をし、そのまま炭素と結合すると同時に、脱離基が脱離し、その過程でその分子の立体配置が反転します。(この反転現象をWalden反転という)下の図の一番左に非共有電子対とマイナス入れるの忘れました。想像で補ってください。
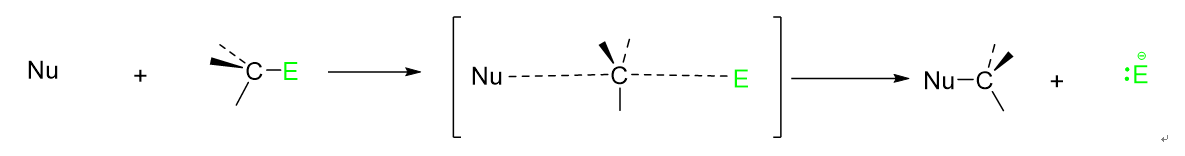
Eは脱離基(Elimination group)の略
以上がSN2反応についての説明です。
次はそのSN2反応がどんな時に起こりやすのか、その条件は何かということを、上記の4つの要因に分けてみてみよう。
①基質の置換様式
この反応は求核試薬が背面攻撃を仕掛けることによっておこる、つまり、求核試薬は脱離基がついている炭素に接近しなければこの反応は起こらない。
攻撃目標である炭素に接近しやすいほどこの反応は起こりやすいということである。
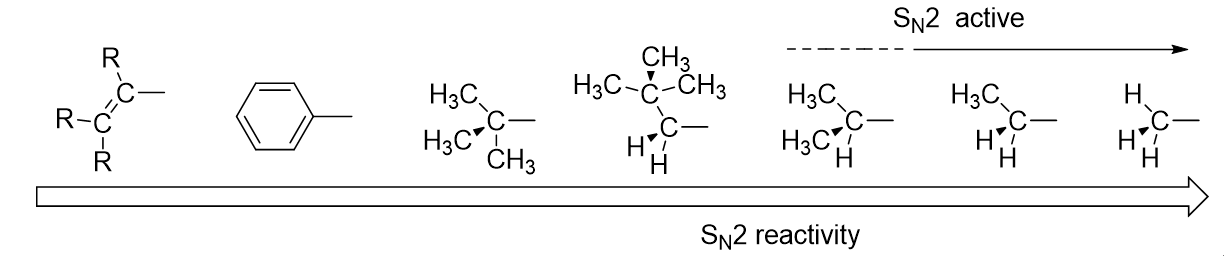
具体的には脱離基がついている炭素について、
メチル>第一級>第二級>ネオペンチル>第三級の順番で反応性が高いことを示す。
それぞれの相対反応性は2000000>40000>500>1>~1という具合である。
つまり、SN2反応が起こるのはメチル、第一級、あとせいぜい第二級までだということがわかる。
また、アルケニルやアリールの場合は全く反応しない。その理由としては、おそらく、C=C結合に接近する際の立体障害が大きいからだと思われる。
上記のSN2反応における相対反応性について図でまとめたら以下のようになる。
②脱離基
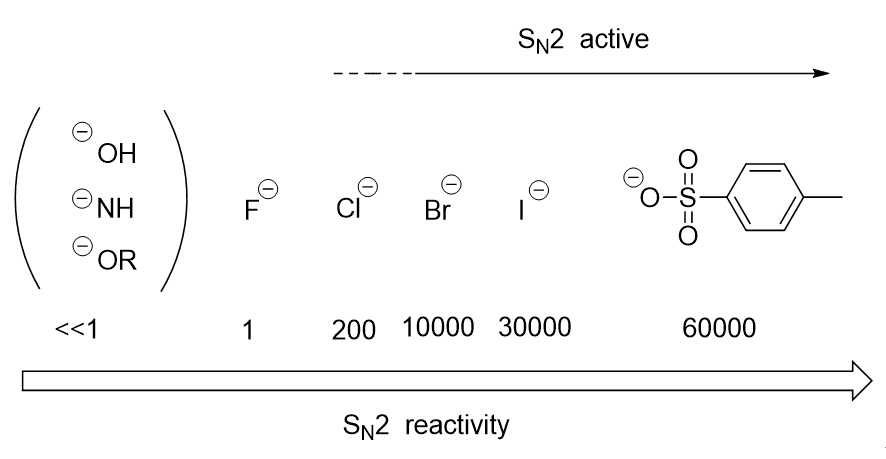
この反応では脱離基は最終的に負のイオンになる。そのため、負電荷を安定化できる置換基のほうが反応が進みやすいことがわかる。
具体的な順番はトシラート(tosylate)(60000)>ヨウ素(30000)>臭素(10000)>塩素(200)>フッ素(1)>OH-、NH2-、OR–(>>1)の順番で(( )内はフッ素を1としたSN2反応の相対反応性である。)これから、SN2反応は脱離基がトシラート、ヨウ素、臭素、せいぜい塩素でないと起こらないことがわかる。
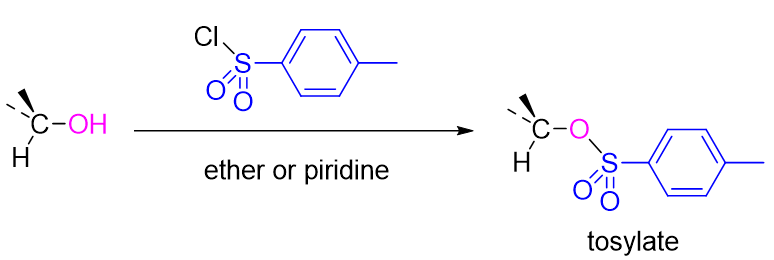
そのため、例えば、-OH基を求核置換に対して活性にしたい場合は塩化p-トルエンスルホニルで処理して、トシラートに変えることでできる。また、この処理過程では炭素の立体配置は変わらない。この詳細な反応機構はこちら。
エーテルでも通常の条件でもSN2反応おこす例外がある。それはエポキシドである。3員環エーテルであるエポキシドは角ひずみのために反応性が高いため、SN2反応を起こす。ここでは具体的な反応については触れない。
③求核試薬
中性か負に帯電しているかにかかわらず、非共有電子対さえ持っていれば(すなわちLewis酸でさえあれば)非常に多くの化学種が求核試薬として働くことができる。
しかし、やはり反応性となると求核試薬の種類によって大きく違いが出でくる。
実測の求核性に対する詳細な説明は難しいが、そのなかでも大まかな傾向は存在するので、SN2反応におけるその傾向を下に挙げてみる。
同じ原子ならば、負電荷をもっているほうが反応性が高い。
つまり、下図のような反応性の関係がある。
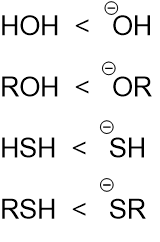
塩基性度が高いほうが反応性が高い
これは当たり前で求核性と塩基性は大まかな相関性があるのは明らかである。
周期表の下に行けば行くほど反応性が高い
具体的な例を出すと、ヨウ素>臭素>塩素の順で反応性が高くなる。これはなぜかというと、原子が大きいと瞬間瞬間に存在する電子の存在密度の偏りが大きくなる(分極率が大きくなる)ので、基質の炭素から遠くても相互作用ができるからである。
つまり、弱い塩基で優秀な脱離基であるにも関わらず、ヨウ素は優秀な求核試薬ということだ。これは直前に挙げた傾向に少々矛盾するきらいがあるが、それは例外ということで押さえておきたいポイントである。
SN2反応では求核剤の嵩高いと反応性は悪くなる。
これはSN2反応に特有でいえることなのだが、求核剤が嵩高いとそれが立体障害となって基質の炭素に近づくことができない。具体的な例としては、tert-BuO–はほぼ置換しない。主に脱離反応が起こる。(E2反応)
④溶媒
溶媒は下のように大きく3つに分けることができるが、SN2反応では②の溶媒が適切である
①非プロトン性 非極性溶媒
②非プロトン性 極性溶媒
③プロトン性 極性溶媒
なぜ②が適切であるかというと、求核試薬とのペアであったカチオンを仮にM+とすると、これのまわりに非プロトン性極性溶媒はとりつき、求核試薬との距離を離してくれるため、求核試薬が働きやすくなるためである。
①だと、そもそも極性が強い求核試薬が溶けないため不適切で、
③だと解離したプロトンが求核試薬と溶媒和(solvation)することによって求核試薬のエネルギーと反応性を低下させるため不適である。
非プロトン性であると、以下のようにプラスの電荷が分子の内側にくることが多いです。
そのため、負電荷をもつ$\rm Nu$との溶媒和による影響は無視できます。
(上の図は代表的な非プロトン性極性溶媒のDMSOです。)
SN2反応における代表的な非プロトン性極性溶媒としてはDMSO(ジメチルスルホキシド)やアセトニトリル、DMFやHMPAが存在する。