



被験物質が含まれた溶液に電極を設置し、その電極間の電位を一定の速さで掃引する手法である。様々な情報が得られるが、例えば、酸化ピークと還元ピークは少しの電位差だけ離れているが、この2つのピークの平均は還元電位と良い近似で一致する。
引用箇所)
サイクリックボルタンメトリーでは、電極に加える電位差を設定した2つの電位の間で行き来させて一定の速さで直線的に掃引した際の、電極と被験物質を含んだ溶液中の界面における電子移動である電流を測定する。この手法では還元電位や酸化還元に関連した化学反応、触媒活性や酸化生成物・還元生成物に関する情報を直接得ることができる。電気的に活性な化合物の酸化還元特性に関する定性的な情報を素早く得ることや、それらに関する熱力学や、速度論的な信頼できる定量情報を得ることに適している。
理想的な場合、酸化ピークと還元ピークは大きさが同じ程度であり、少しの電位差だけ離れている。この2つのピークの平均は還元電位と良い近似で一致する。
シュライバー・アトキンス 無機化学 上 第6版 p

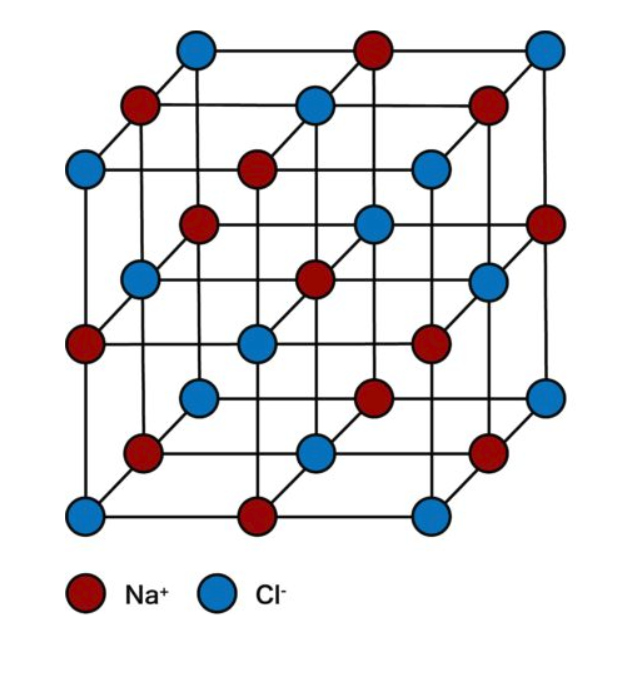
 Naの配位数:6
Naの配位数:6
Clの配位数:6
単位格子中に含まれるNaClの個数:4
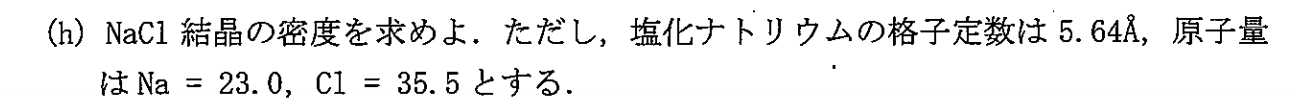 \begin{eqnarray}
\begin{eqnarray}
ρ&=&\f{(23.0+35.5)×4×\f{1}{6.02×10^{23}}}{(5.64×10^{-8})^3} \\
&=& 2.16[{\rm g/cm^{-3}}]\\
\end{eqnarray}

最近接イオン間距離が同じである場合は、マーデルング定数が大きい構造のほうが安定である。よって、CsCl型構造をとることができるならば、静電的に有利なのは、CsCl型構造である。
 ※
※
半径比は単なる指標に指標にすぎない。全体の$\f23$程度のイオン性化合物が予測どおりの充填配列を取るが、残りの$\f13$はそれに従わない。その理由は、充填配列を決める要因は半径比だけではないからだ。半径比だけだと、イオン性化合物の共有結合性を無視している。つまり、イオン結合性化合物でも少なからず共有結合性を持っている。そのため、イオンの剛体球モデルが無条件で適合するわけではない。例えば、硫化水銀(Ⅱ)は半径比だけから予想すると、$r_+/r_-=0.55$なので、$\rm NaCl$と同じ面心立方格子を取ると予想される。しかし、実際には、$\rm ZnS$と同じような閃亜鉛鉱構造をとる。これは硫化水銀(Ⅱ)はとても共有結合性が高く、しばしば四面体配置の4本の共有結合を形成するからだ。つまり、共有結合性により、四面体構造である閃亜鉛鉱構造を優先して取ることが説明できる。逆に、ヨウ化リチウムの場合は半径比からは$r_+/r_-=0.35$なので、$\rm ZnS$と同じ閃亜鉛鉱型であると予想される。しかし、実際には$\rm NaCl$と同じ面心立方格子をとる。これも、共有結合性により説明されている。この化合物における約30%は共有結合性であると信じられており、リチウムの電子密度は球形ではなく、周囲の6個の陰イオンの方向に引き伸ばされた形になっている。したがって、面心立方格子をとると言われている。
また、多くの場合、異なる充填配列間のエネルギー差は多くの場合、非常に小さい。そのため、圧力をかけるなどで、充填配列が変わる場合もある。例えば、塩化ルビジウムは室温では塩化ナトリウム型を取るが、圧力をかけることで塩化セシウム型になる。
さらに、イオン半径はいろいろな異なる環境で常に一定の値をとるわけではない。
 水分子$\rm H_2O$が遷移金属に配位している錯体、例えば、$\rm [Ni(H_2O)_6]^{2+}$などである。
水分子$\rm H_2O$が遷移金属に配位している錯体、例えば、$\rm [Ni(H_2O)_6]^{2+}$などである。
※補足
$\rm [Ni(H_2O)_6]^{2+}$をアンモニア$\rm NH_3$と反応させることで置換反応がおこり、$\rm [Ni(H_2O)_{6-n}(NH_3)_n]^{2+}$が生成します。このように、水分子が他の配位子と置換する反応をアネーション反応、その逆をアクア化反応と呼ばれます。
 分子内に酸化数の異なる金属イオンをもつ錯体のことで、クラスⅠ~Ⅲに分類される。クラスⅠは金属間にまったく相互作用がなく、電荷が局在しているもの、逆にクラスⅢは電荷が非局在化しているもの、クラスⅡはその中間のものである。たとえば、$\rm CaCl_2$はクラスⅠに分類される。
分子内に酸化数の異なる金属イオンをもつ錯体のことで、クラスⅠ~Ⅲに分類される。クラスⅠは金属間にまったく相互作用がなく、電荷が局在しているもの、逆にクラスⅢは電荷が非局在化しているもの、クラスⅡはその中間のものである。たとえば、$\rm CaCl_2$はクラスⅠに分類される。
参考ページ)混合原子価化合物
 $\rm d^4~d^7$電子をもつ六配位八面体遷移金属錯体は、高スピンジュオ体と低スピン状態を取り得るが、それらの間にエネルギー差はほとんどなく、温度や圧力あるいは光などの外部刺激により、最も安定な状態(基底状態)のスピン状態が変化する錯体のこと。例えば、$\rm [Fe(phen)_2(NCS)_2]$は184K以下では反磁性、188K以上では常磁性を示す。
$\rm d^4~d^7$電子をもつ六配位八面体遷移金属錯体は、高スピンジュオ体と低スピン状態を取り得るが、それらの間にエネルギー差はほとんどなく、温度や圧力あるいは光などの外部刺激により、最も安定な状態(基底状態)のスピン状態が変化する錯体のこと。例えば、$\rm [Fe(phen)_2(NCS)_2]$は184K以下では反磁性、188K以上では常磁性を示す。

