【ア】ネルンスト
【イ】標準電極電位
【ウ】ファラデー
【エ】活量
(1)-a-iiの解説
正極と負極では以下の反応が起こっている。
\rm 正極:Cu^{2+}+2e^-⇄Cu\\
負極:Zn^{2+}+2e^-⇄Zn
よって、
\begin{eqnarray}
ΔE&=&E_{正極}-E_{負極} \\
&=&(E\stst_{正極}+\f{RT}{F}\ln{\f{[\rm Ox]}{[\rm Red]}})-(E\stst_{負極}+\f{RT}{F}\ln{\f{[\rm Ox]}{[\rm Red]}})\\
&=&(E\stst_{{\rm Cu}^{2+}/{\rm Cu}}+\f{RT}{F}\ln{\f{[\rm Cu^{2+}]}{[\rm Cu]}})-(E\stst_{{\rm Zn}^{2+}/{\rm Zn}}+\f{RT}{F}\ln{\f{[\rm Zn^{2+}]}{[\rm Zn]}})\\
&=&(+0.34+\f{RT}{F}\ln{(1.0×10^{-1}}))-({-0.76+\f{RT}{F}\ln{(1.0×10^{-2}}}))\\
&&(\because [{\rm Zn}]=[{\rm Cu}]=1(固体は1と約束する。))\\
&=&1.10+\f{RT}{F}\ln{\f{1.0×10^{-1}}{1.0×10^{-2}}}\\
&=&1.10+\f{RT}{F}\ln{10}\\
&=&1.10+0.060\\
&=&1.16[{\rm V}]
\end{eqnarray} となる。
ネルンストの式で起電力を求める詳しい解説はこちらを御覧ください。
(1)-bの解説
【オ】2
【カ】折れ曲り形
【キ】1
【ク】折れ曲り形
【ケ】3
【コ】T字形
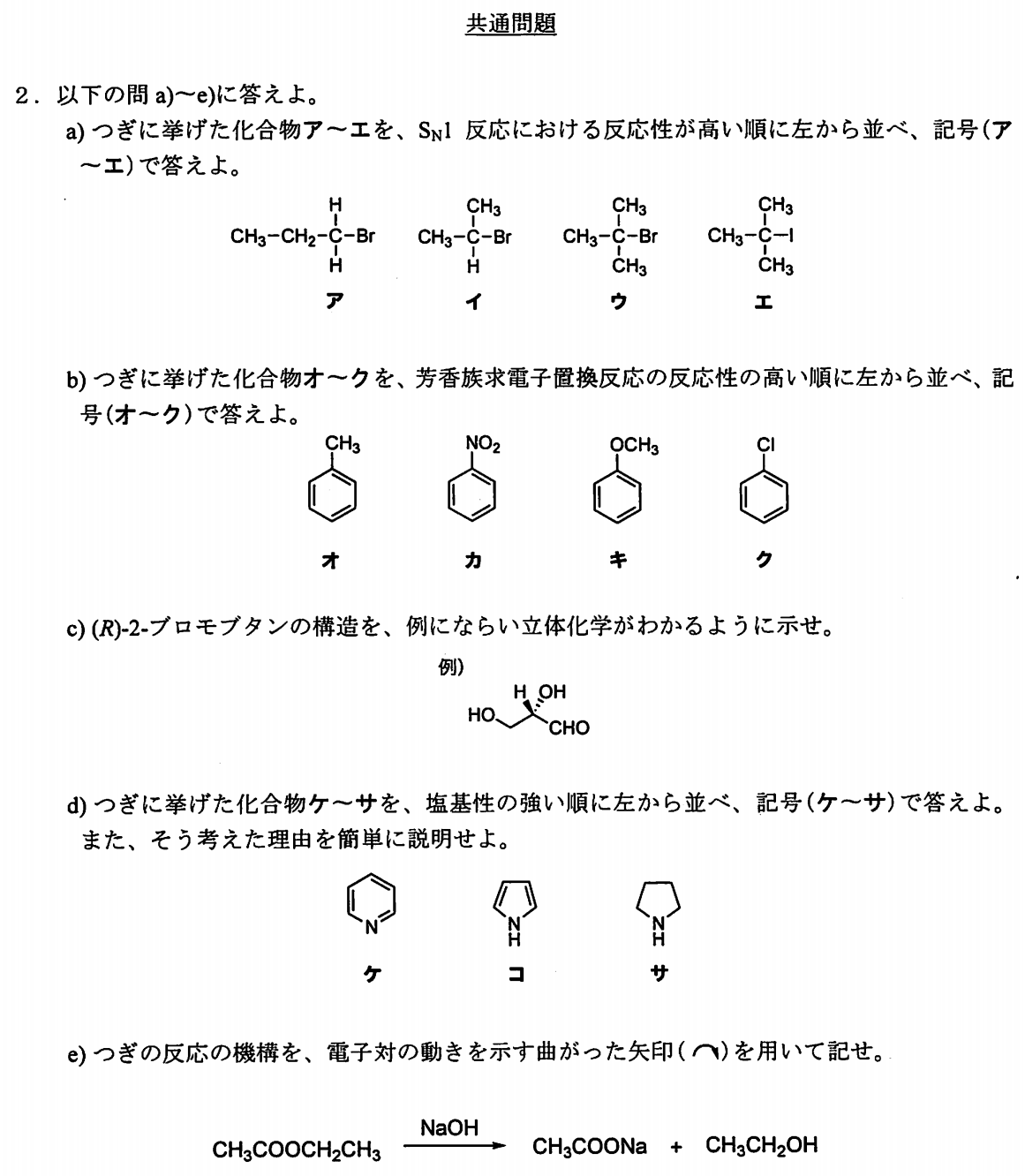
(2)-aの解説
エ>ウ>イ>ア
(2)-bの解説
ク>キ>オ>カ
(2)-cの解説
(2)-dの解説
ピロリジンは、特に塩基性に影響を及ぼす構造上の因子が無く、一般的な脂肪族アミンと同程度の塩基性を有します。芳香族は脂肪族より塩基性が落ちます。なぜなら非局在化しているためです。その芳香族の内でも、非共有電子対がピリジンではsp2混成軌道に入ってますが、ピロールの場合はp軌道に入っていて直接芳香族性に関与してるため、その非共有電子対がピロールのほうがプロトンとの結合に用いにくいです。そのため、塩基性度はピロリジン>ピリジン>ピロールとなります。 サ>ケ>コ
芳香族は脂肪族より非局在化のため、Nに電子を供給しにくいため塩基性が低い。
また、ピリジンとピロールを比べると、ピロールの非共有電子対は直接$π$共役系に関与しているため、この非共有電子対がプロトンとの結合に使われるとより不安定化する。
(2)-eの解説
 (3)以降の解答は製作中です。
(3)以降の解答は製作中です。
